|
|
|
Auf
Bild 4 ist ein toter Siebenschläfer (Glis glis) zu sehen, das
Foto wurde im Slowenischen Karst aufgenommen. Bild 5 zeigt eine
moderne Siebenschläfer- bzw. Bilchfalle, so wie sie heute auf
den Märkten in der Slowenischen Innerkraina angeboten werden.
Das Foto wurde in Logatec (Ober- / Unterloitsch) auf einem Markt
aufgenommen.
|
|
|
|
|
|
Fotos: Hartwig, A.
(9/2004): Bild 1 bis 4, Bologna, S. (9/2004): Bild 4 u. 5
|
|
|
|
|
|
[39]
- Info: Ausstellung >>Parasiten – Leben und leben
lassen<<, Sonderausstellung des Museums für Naturkunde
der Humboldt-Universität zu Berlin im Universitätsklinikum
Göttingen (11/2003-2/2004).
|
|
|
|
|
|
[40]
- SC Johnson Wax gmbH / Autan (2003): Natur entdecken ohne
Zecken – der Autan-Gesundheitsratgeber zum Thema Zecken,
Vorwort – Vermeidung von Zeckenstichen ist der beste
Gesundheitsschutz (von: Prof. H. Mehlhorn,
Heinrich-Heine-Universität Institut für Zoomorphologie,
Zellbiologie und Parasitologie, Düsseldorf), S. 4-5
|
|
|
|
|
|
[41]
- Fritzsche, M (11.07.2004): freundlicher Hinweis per E-Mail. Dr.
M. Fritzsche nimmt unter der Leitung von Prof.
Mayorov an der Borrelia-EEG-Forschsungstudie teil.
Er hat sich unter anderem während seiner Doktorarbeit mit der
humanen Zystizerkose (T. Solium = Schweinebandwurm) befasst.
|
|
|
|
|
|
Die
Zystizerkose verläuft häufig auch subklinsch, bzw. ohne
eindeutige Symptome, ähnlich einer L-Form-Borreliose. Bei
dieser relativ häufigen Erkrankung mit Finnen des
„Blasenbandwurms“ (T. Solium) kann es zu
organspezifischen Symptomen, vor allem an den Augen und dem
Großhirn kommen. Seltener kommt es zu rheumatischen
Symptomen und Knotenbildung im Bindegewebe und den Skelettmuskeln.
|
|
|
|
|
|
[42]
- MRT oder MRI-Verfahren (magnetic
resonance
imaging)
sind weitläufiger als Kernspinresonanztomographie bekannt.
Dies ist ein computergestütztes bildgebendes Verfahren, bei
dem mittels Magnetfeld mit hoher Feldstärke, Protonen der
Wasser- u. Fettbestandteile im Organismus angeregt werden.
|
|
|
|
|
|
[43]
- Gadolinium: (Gd)-Komplexverbindung (Seltenerdmetall) wird als
Kontrastverstätker beim MRT-Verfahren eingesetzt. Mit Gd
können auch schwächere Unterschiede (Anomalien) besser
und kontrastreicher sichtbar gemacht werden
|
|
|
|
|
|
[44]
- Kurze Erklärung zum HLA-Faktor: Beim
HLA-Faktor (Histokompatibilität-Locus[Ort]-Antigen)
handelt es sich um den sogenannten Histokompatibilitäts- bzw.
um die Histoinkompatibilitätsgene, die für das
Immunsystem als körpereigen Kodierung sehr wichtig sind. Das
HLA-System wird auch MHC (Major
Histocompatibility
Complex)
bzw. MHS (Major
Histocompatibility
System)
oder human leukocyte
antigen (HLA) genannt. Zu
Deutsch spricht man auch von Haupt-Histokompatibilitätskomplex.
Der HLA-Faktor ist im kurzen Chromosom 6 zu suchen, wird dort
wiederum nach der Lage (Gen -Locus) im wesentlichen in zwei
Klassen eingeteilt. Der DR-Faktor gehört zur Klasse 2, und
ist als "Kodierung" in nachfolgenden Immunzellen des
Körpers zu finden: B-Zellen (hier ein Zusammenhang zum
B-Zell-Krebs ?), inaktivierte T-Zellen, Makrophagen (Versteck der
Borrelien in den Makrophagen? - am Tiermodell beobachtet),
Endothelzellen (innerste Zellschicht d. Gefäße, des
Rippenfells u. Bauchfells) den sogenannten Langerhalszellen der
Epidermis (Zellen der Oberhaut - Zusammenhang zum EM u./o. d. ACA
?) und Spermatozyten.
|
|
|
|
|
|
Da
die Borrelien anscheinend zur Tarnung den HLA-Faktor der Klasse 2
(Gen-Locus DR) nutzen, wäre vielleicht auch denkbar
(Spekulation Autor), dass eine der Ursachen der Diabetes mellitus
Typ 1 (Insulinabhängige) in einer (früh)-kindlichen
Borrelieninfektion zu suchen ist. Sind Kinder doch durch ihr
Spiel-Verhalten besonders für Zeckenstiche prädestiniert.
|
|
|
|
|
|
Bei
der Diabetes vom Typ 1 geht man heute von einem Infekt im
Kindesalter aus, der die Zellen der Bauchspeicheldrüse
(Pankreas, Langerhans-Insel, B-Zellen, Beta-Zellen) zerstört,
welche beim gesunden Menschen das Insulin produzieren. Es
liegt beim Diabetes Typ 1 nachweislich eine HLA-DR3 assoziierte
Autoimmunopathie vor. Betrachtet man nun die Nähe von
HLA-DR3, zu HLA-DR2, so könnte hier ein Zusammenhang
bestehen. Diabetes Typ 1 tritt bei Trägern des HLA-DR3 und
HLA-DR4 Faktors etwa 20mal häufiger auf als bei Trägern
anderer HLA-Faktoren. Weiter liegt der Gewebefaktor von ca. 50 %
der Rheumapatienten in dieser gefährlichen Nähe, sie
sind nämlich Träger des Gewebefaktors HLA-DR4, auf dem
eine Immunopathie durch das Borrelien OspA ausgelöst werden
kann [50/52].
Träger des HLA-DR4 Faktors sind im Vergleich zum Durchschnitt
sechsmal so stark gefährdet, an rheumatoider Arthritis zu
erkranken und Patienten mit dem Faktor HLA-DR2 viermal anfälliger
für Multipler Sklerose.
|
|
|
|
|
|
So
sind z.B. 50 Prozent Rheuma-Patienten Träger des
Gewebefaktors HLA-DR4, jeder fünfte Bundesbürger besitzt
diesen Gewebetyp.
|
|
|
|
|
|
Erklärung
zum Diabetes Typ 1: Als Ursache für den
Diabetes Typ 1 wurden inzwischen Autoimmunprozesse anerkannt. Es
konnten hierfür in letzter Zeit einige Autoimmun-Antikörper
klassifiziert werden - z.B. Autoantikörper gegen
Glutamatdecarboxylase (GADA), gegen Tyrosinphosphatase (IA2A) und
gegen Insulin (IAA).
|
|
|
|
|
|
So
besteht z.B. in der Tat ein Kreuzreaktionsverhältnis zwischen
dem Borrelin-OspA und dem menschlichen Pro-Insulin, welches die
Vorstufe des eigentlichen Insulins ist und immunogene
Eigenschaften besitzt. Allerdings konnte zur Zeit noch keine
diagnostizierte “low-dose-borreliosis“ mit einer
späteren Diabetes vom Typ 1 in direkter Verbindung gebracht
werden. Man muss aber auch bedenken, dass eine Bb-Diagnose ohnehin
Probleme bereitet und das die Kreuzreaktion im Detail noch nicht
vollends gesichert bzw. noch nicht lange bekannt ist. Weiter
mögliche Antworten hierauf sind:
|
|
|
|
|
|
1.-
Es besteht trotz Kreuzreaktionverhältnis (Bb-OspA /
Pro-Insulin) keine krankhafte (pathogene) Verbindung zwischen den
Borrelien und der Diabetes vom Typ 1.
|
|
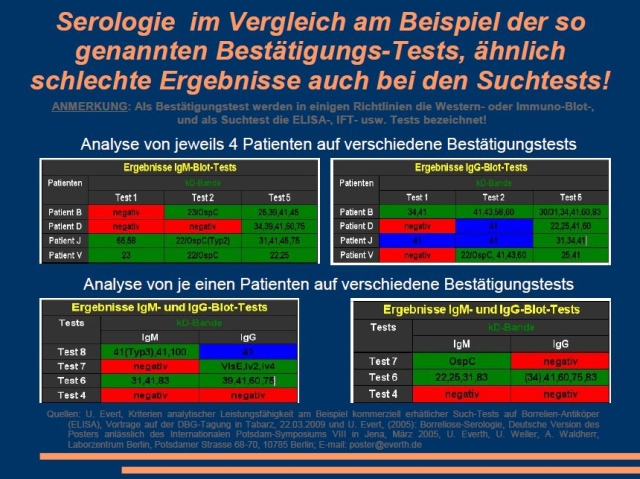
|
|
|
|
2.-
Wegen genetischer oder Struktur-dominater Prädisposition
erfolgt keine serologisch nachweisbare Aktivierung spezifischer
Bb-Antikörper, sondern statt dessen werden nur sogenannte
Bystander [52]
aktiviert. Unter Bystander
versteht man in der Immunologie, Immunzellen mit AG-Peptiden
(Kontaktstellen der Rezeptoren), die eine dem Original ähnliche
kristalline Kontakt-Struktur (ca. 50 % Ähnlichkeit genügen)
besitzen.
|
|
|
|
|
|
3.-
Der Kontakt zum Bb-OspA bestand vor der endgültigen
Immunsystemausreifung (< 4. Lebensjahr) des DiabetesTyp
1-Patienten und die aktivierten Bystander überschritten erst
Jahre später nach der Borrelia-Initial-Infektion den
Schwellenwert von nicht krankmachend zu krankmachend.
|
|
|
|
|
|
Ein
weiteres Indiz für eine einmalig fehlgeleitete Immunabwehr
(z.B. durch Borrelien-AG-Mimikry) könnte eine jüngst
gemachte Entdeckung liefern. Es konnte nämlich bei Patienten
in Versuchen ein zweites Immunsystem mittels
Spender-Immun-Stammzellen aufgebaut werden, so dass eine Toleranz
gegen die Spender-Inselzellen (insulinproduzierende Zellen)
erreicht wurde [51].
Bei diesem künstlich induzierten Doppel-Immunsystem leben
quasi die fremden und körpereigenen Zellen friedlich in
Koexistenz. Das Erstaunliche daran (in Bezug auf Diabetes Typ 1)
ist, dass nicht nur die Spender-Inselzellen Insulin produzieren,
sonder dass die Immunzellen verschwinden, die bis dahin die
körpereigenen Inselzellen zerstört haben. Erklärbar
ist dies eventuell damit, dass die alten körpereigenen
Inselzellen komplett durch die neuen Spender-Inselzellen ersetzt
werden und die bis dahin vorhandene Prädisposition verloren
geht. Dadurch haben die fehlgeleiteten (z.B. durch Borrelien
Vls-AG) Immunzellen kein Angriffsziel mehr, da auch die Borrelien
schon längst ein anderes Tarnkleid übergestülpt
haben.
|
|
|
|
|
|
Beim
Typ 2 der Diabetes (nicht Insulinabhängig) hingegen binden
Rezeptoren der Fettzellen das Insulin, hierdurch wird der
Glucosehaushalt der Zellen gestört und es kommt zu hohen
Blutzuckerwerten im Blut.
|
|
|
|
|
|
[45]
- Hier könnte auch ein Zusammenhang zur
Multiplen Sklerose bestehen. Es wird in der Fachliteratur
berichtet, das Personen die den Faktor HLA DR2 als erblich Anlage
mitbekommen haben, einem vierfach höheres Risiko (1 : 250)
ausgesetzt sind, an der MS zu erkranken.
|
|
|
|
|
|
[46]
- DAKO A/S (1995): IDEIATM Borrelia
burgdorferi-IgG-Kit, Enzymimmunoassy zur Bestimmung von
IgG-Antikörpern gegen Borrelia burgdorferi in Humanserum,
Golstrup, Denmark
|
|
|
|
|
|
[47]
- Hansen, K. (1995): Lyme-Borreliose, DAKO A/S, Glostrup, Dänemark
|
|
|
|
|
|
[48]
- Lessell, C. B. (1990): Lyme-Krankheit, Die Behandlung von
Zeckenbissen, Homöopathisches Reisehandbuch, Knaur, S.
210-213, ISBN 3-426-76065-7
|
|
|
|
|
|
[49]
- Nataša Prestor ist eine slowenische Keramik-Künstlerin
aus dem Gebiet der Notranjska (Innerkrainer), die sich in ihren
Kunstwerken hauptsächlich der Geschichte, den Sagen und der
Natur ihrer Heimat widmet. Ihr Künstleratelier liegt im
Herzen der Notranjska im Planinsko polje (Kesseltal von Planina),
im Dorf Laze nördlich von Postojna, dem früheren
Adelsberg - also inmitten der Region, in der es heute noch
Tradition ist, den Siebenschläfern im Herbst nachzustellen.
|
|
|
|
|
|
Atelieradresse:
Nataša Prestor - Laze 3 - 1370 Logatec – Slowenien /
Slovenija
|
|
|
|
|
|
[50]
- Manniche,
V.S. (1993): 1,2 Millionen Deutsche leiden unter Gelenkrheuma
>>Das falsche Feindbild macht krank<< Rheuma ist eine
schlimme Volkskrankheit. Noch legen die Ursachen im Dunkeln. Klar
ist, was die schmerzhaften Gelenkschäden hervorruft: Ein
fehlgeleitetes Immunsystem, das gegen Freund und Feind
gleichermaßen losschlägt., Illustrierte
Wissenschaft, Verl. Bonnier Publication A/S Filiale
Norderstedt, S. 34-37, J. 7/93
|
|
|
|
|
|
[51]
- Hallricher, K. (2004): Transplantation, Glänzender Erfolg –
Zum ersten Mal ist es Ärzten gelungen, nach einer
Transplantation die Abstoßungsreaktion im menschlichen
Körper langfristig ohne Medikamente zu verhindern. Bild
der Wissenschaft, S. 33, J. 8/04
|
|
|
|
|
|
[52]
- Kamradt, T. (2002): Aktivierung
und Differenzierung von T-Lymphozyten durch Infektion und
Autoimmunität, 4.1 Aktivierung von Th-Zellen bei
Infektion und Autoimmunität: Molekulare Mimikry als Ursache
für Autoimmunität ?,
S. 22,
http://edoc.hu-berlin.de/habilitationen/kamradt-thomas-2001-05-29/HTML/kamradt-ch4.html
|
|
|
|
|
|
[53]
- Bjorkmanet al. (1987); Falk, Rötzschke, Stevanovic, Jung u.
Rammensee (1991); Jardetzky, Lane, Robinson, Madden u. Wiley
(1991); Madden, Gorga, Strominge u. Wiley (1992); Brownet al.
(1993); Reay u. Kantor (1994); Wucherpfennig u. Strominger (1995);
Hemmer, vergelli, Pinilla, Houghten u. Martin (1998); Hammeret al.
(1998); Maier u. Molinger (2000) - nachzulesen unter Karmradt, T
[52].
|
|
|
|
|
|
[54]
- Oberholzer, A. (2000): Immundysfunktion nach Trauma,
Projekt-Nr.: GRS-027/98, Uni-Spital Zürich
|
|
|
|
|
|
[55]
- Krzyzanowska, K. (2005): Die Bedeutung erhöhter IL-18
Konzentration für die Entstehung des metabolischen Syndroms,
Intressantes, Diabetes-Highlights, Woche 13 / 2005, www_aventis_at
Diabetes Highlights.htm
|
|
|
|
|
|
[56]
- Unsicker, C. (2002): Induktion
von Matrixmetalloproteinasen und Interleukin-18 durch Borrelia
burgdorferi in vivo und in vitro, Dissertationfreigabe 22.10.2002,
Digitale Dissertation, Freie Universität
Berlin
|
|
|
|
|
|
[57]
- Mühl, H. (2005): Interleukin-18: Ein konstitutiv
exprimiertes pro-entzündliches Zytokin, Interleukin-18
als Angriffspunkt antientzündlicher Therapie, schlaglicht,
Biospektrum, 11. Jg., J. 1/05, S. 38-40,
http://www.biospektrum.de/pdf/1649.pdf
|
|
|
|
|
|
[58]
- Gessner, A., Röllinghoff, M. (2002): Diagnostik und
Pathogenese der humanen Neuroborreliose, Entzündungsprozesse:
Genese, Diagnostik und Therapie – Teilprojekt A2,
BMFB-Projekt Interdisziplinäres Zentrum für klinische
Forschung, Institut für Klinische Mikrobiologie, Immunologie
und Hygiene, Friedrich-Alexander-Universität Erlangen -
Nürnberg
|
|
|
|
|
|
[59]
- Lidtke, S. (2005): Tarnkappe der Borrelien teilweise gelüftet,
Erfolgreiche Kooperation in der Infektionsbiologie, Biologie u.
Biotechnologie – Chemie u. Biochemie – Medizin u.
Gesundheitswissenschaften, Leibniz-Institut für
Naturstoff-Forschung und Infektionsbiologie –
Hans-Knöll-Institut, 3/05
|
|
|
|
|
|
[60]
- Feige,
B. Fingerle V, Weiler S, Wussow A, Wilske B, Solbach W, Kessel, R.
(2004): Borrelia-burgdorferi-Durchseuchungsraten von Schildzecken
(Ixodes ricinus) in Schleswig-Holstein, Forschung, Beiträge
zur 44. Jahrestagung der Deutschen Gesellschaft für
Arbeitsmedizin und Umweltmedizin e.V gemeinsam mit der
Österreichischen Gesellschaft für Arbeitsmedizin vom
21.- 24. April 2004 in Innsbruck, Universitätsklinikum
Schleswig-Holstein - Campus Lübeck - Institut für
Arbeitsmedizin
|
|
|
|
|
|
[61]
- Fallon, BA, Nields, JA. (1994):
Lyme disease: a neuropsychiatric illness., Deperment of
Psychiatry, College of Physicians and Surgeons, Columbia
University, New York, Am J Psychiatry 1994, 151, S. 1571-1583
|
|
|
|
|
|
[62]
- Baumann, G. (2004): Seroepidemiologische
Untersuchungen zur Lyme-Borreliose in Süddeutschland,
1991-1993, Dissertation, Max von Pattenkofer-Institut für
Hygiene und Medizinische Mikrobiologie,
Ludwig-Maximilians-Universität München
|
|
|
|
|
|
[63]
- Ströder, J. (1989): Die Lyme-Krankheit – Eine
klinische Synopsis, Der kinderarzt, S. 799-805, Nr. 6, J. 89
|
|
|
|
|
|
[64]
- Donner, S. (2005): Sprachkurs für Gene – Die
Gentechnik scheitert oft an Sprachprobleme, denn verschiedene
Lebewesen benutzen unterschiedliche Dialekte für ihre Gene.
Deutsche Forscher bieten einen Ünersetzungsservice an., Bild
der Wissenschaft, S. 36-38, J. 9/05
|
|
|
|
|
|
[65]
- Lange, T. (2005): Hoffnungsträger sind Mangelware –
Ein Patent läuft aus, Bild der Wissenschaft, Verl. Deutsche
Verlags-Anstalt GmbH – Stuttgart, S. 110, J. 12/05
|
|
|
|
|
|
[66]
- Landesarbeitsgruppe Borreliose und FSME Beden-Württemberg
e.V. / c/o Landesgesundheitsamt, Wiederholdstraße 15, 70174
Stuttgart): Antibiotische Prophylaxe nach Zeckenstich – ja
oder nein?, Grundlagen, Merkblatt 2, Borreliose und FSME
Beden-Württemberg e.V. / c/o Landesgesundheitsamt,
Wiederholdstraße 15, 70174 Stuttgart
|
|
|
|
|
|
[67]
- Schlotzhauer, A. (2003): Untersuchung zur Gegenregulation
eukaryoter Gene in Borrelien-infizierten Endothelzellen
,Dissertation, Institut für
Medizinische Mikrobiologie und Krankenhaushygiene der MHH,
Fachbereich Chemie der Universität Hannover
|
|
|
|
|
|
[68]
- Kraus et. alt (2004): Zoonosen, 3. Aufl., Deutscher Ärzte-Verlag
(extra_2129.pdf)
|
|
|
|
|
|
[69]
- Brorson, Ø.
u. Brorson, S.H. (1998): In vitro conversion of Borrelia
burgdorferi to cystic forms in spinal fluid, and transformation to
mobile spirochetes by incubation in BSK-H medium, Infection 26, S.
144-150
|
|
|
|
|
|
[70]
- Schmedt, C. (2005/2006): Borreliose-Klinik und Therapie der
Lyme-Borreliose, Stand 1/2006, Borna-Diesease-virus (BDV), Stand
10/2005, priv. Hompage, www.borna-borreliose-herpes.de
|
|
|
|
|
|
[71]
- RKI / Mehnert, W. H. (2005): Zur Situation bei wichtigen
Infektionserkrankungen in Deutschland: Neuerkrankungen an
Lyme-Borreliose im Jahr 2004 / Analyse auf der Basis der
Meldedaten aus den sechs östlichen Bundesländern,
Epidemiologisches Bulletin - Aktuelle Daten und Informationen zu
Infektionskrankheiten und Public Health, Nr. 32, S. 285-288,
12.08.05
|
|
|
|
|
|
[72]
- Thimm, U. (1998): Warum das Influenza-Virus eine
Lungenentzündung verursacht, Pressemitteilung: Wie werden
Viren zu Krankheitserregern, Forschungsgruppe: Biologie und
Biotechnologie - Medizin und Gesundheitswissenschaften,
Justus-Liebig-Universität Gießen, Nr. 43,
http://idw-online.de/pages/de/news4554
|
|
|
|
|
|
[73]
- Mutz, D.
(2004): Identifizeierung von Bindungspartnern des cytosolischen
Teils a3-Integrin-Untereinheit
und die Aufklärung ihrer Rolle bei der Funktion der
a3b1-Integrins, Dissertation,
Freie Universität Berlin, Fachbereich Biologie, Chemie,
Pharmazie, 25.08.2004 - Ausschnitt unter:
www.diss.fu-berlin.de/2004/214/Mutz.1.pdf
|
|
|
|
|
|
[74]
- Feige, B., Fingerle, V.,
Weiler, S.W., Wussow, A., Wilske, B., Solbach, W. u. Kessel, R.
(2004): Borrelia-burgdorferi-Durchseuchungsrate in
Schleswig-Holstein, P 12, Arbeitsmed. Sozialmed. Umweltmed., S.
251-251, 39.4.2004
|
|
|
|
|
|
[75]
- Stocker, U., Fingerle, V.,
Hermann, M. u. Wilske, B. (2004): Infektionsepidemiologie
zeckenübertragener Erkrankungen in Bayern: Lyme-Borreliose, P
18, Arbeitsmed. Sozialmed. Umweltmed., S. 251-251, 39.4.2004
|
|
|
|
|
|
[76]
- Diese unterschiedlichen
Symptombild-Assoziationen der verschiedenen Geno-Typen konnte 2005
nochmals bestätigt werden: Michel, H.
(2005): Entwicklung und Evaluierung molekularbiologischer
Nachweismethoden zur Spezies- und OspA-Typ-Differenzierung von
Borrelia burgdorferi sensu lato, Dissertation, LMU München,
Medizinische Fakultät, 24. Nov. 2005,
hiip://edoc.ub.uni-muenchen.de/archive/00004545/
|
|
|
|
|
|
[77]
- Uebermuth, C. (2005): Neue
Erkenntnisse zur Pathogenese der multplen Sklerose - Potenzial für
die Erweiterung der therapeutischen Option: Multiple Sklerose -
eine Zeckenbisserkrankung ?, Medizin, Deutsches Ärzteblatt
print, Diskussion zu den Beitrag von Prof. Dr. med. Ralf Gold,
Jun. Prof. Dr. med. Christine Stadelmann, Dr. med. Ralf Linker,
Dr. med. Ricarda Diem, Prof. Dr. med. Mathias Bähr, Prof. Dr.
med. Wolfgang Brück in Heft 17/2005, Deutsches Ärzteblatt
102, Ausgabe 42 vom 21.10.2005, Seite A-2879 / B-2432 / C-2292
|
|
|
|
|
|
[78]
- Haes, J. A. C. (2003):
Generierung eines rekombinanten Immunoblots als Bestätigungstest
einer Infektion mit Borrelia burgdorferi, Dissertation,
Fachbereich Medizin der Universität Hamburg
|
|
|
|
|
|
[79]
- Fingerle, V., Stocher, U.,
Herrmann, M., Wilske, B. (2003): Infektionsepidemiologie
zeckenübertragener Erkrankungen in Bayeren: Lyme-Borreliose,
LfAS / Bayerisches Landesamt für Arbeitsschutz Arbeitsmedizin
und Sicherheitstechnik
|
|
|
|
|
|
[80]
- Becker, M. (1998): Systematik
von Zecken (und Milben), 9/1998, www.ijon.de/zecken/system.html
|
|
|
|
|
|
[81]
- Gartner, B. (2006):
Schizophrenie - Wahnsinnige Verlockung / In Deutschland leiden
etwa 800000 Menschen an Schizophrenie. Die Patienten leben in
einer ebenso großartigen wie furchterregenden welt. Dabei
ist es immer noch ein Rätsel, wie die Krankheit entsteht.,
Bild der Wissenschaft, Verl. Deutsche Verlags-Anstalt GmbH -
Stuttgart, S.58-63, J. 1/06
|
|
|
|
|
|
[82]
- Warzecha, H. (2006): Forschern
gelingt Produktion von Impfstoff in Tabakpflanzen / Auch in
Pflanzen lassen sich wirksame Impfstoffe in genügend großer
Menge produzieren. Das haben Forscher der Universität
Würzburg, Heidelberg, Freiburg und Clermont-Ferrand am
Beispiel der bakteriellen Infektionskrankheit Borreliose gezeigt.
Ihre Ergenbnisse stellen sie in der Januar-Ausgabe des Fachblatts
“Nature Biotechnology“
vor., Kontakt: warzecha@biozentrum.uni-wuerzburg.de, Quelle:
www.uni-wuerzburg.de/intern/w060125b.html
|
|
|
|
|
|
[83]
- Glenz, K., Bouchon, B., Stehle,
T., Wallich, R., Simon, M. M., Warzecha, H. (2006): “Production
of a recombinat bacterial lipoprotein in higher plant
chloroplast“, Nature Biotechnology Vol. 24, Nr. 1, 1/06, S.
76-77, DOI: 10.1038/nbt1170
|
|
|
|
|
|
[84]
- Kempf, W., Kutzner, H.,
Schärer, L., Schmid, M., Juricevic,. N., Burg, G. (2004): Das
Spektrum der kutanen Manifestationen von Borrelieninfektionen,
Freie Mitteilungen, C 12,
http://content.karger.com/ProdukteDB/produkte.asp?Aktion=ShowPDF&ProduktNr=
227337&Ausgabe=230481&ArtikelNr=81220&filename=81220.pdf
|
|
|
|
|
|
[85]
- Brorson, Ø.,
Brorson, S-H. (2004): An in vitro study of the susceptibility of
mobile and cystic forms of Borrelia burgdorferi to tinidazole,
Reserche Note, International Microbiology, 2004/7, S. 139-142,
www.im.microbios.org
|
|
|
|
|
|
[86]
- Häring, D. (1988): Unfall, Medizinisches Taschenwörterbuch,
Ueberreuter Wissenschaft - Wien - Berlin, S. 355, ISBN
3-8000-3304-6
|
|
|
|
|
|
[87]
- Urban+Schwarzenberg, Unfall, Trauma, Verl., Lexikon Medizin -
Nachschalgwerk f. Ärzte u. Apotheker, U+S Verl., S. 1661 u.
1694, J. 7/200
|
|
|
|
|
|
[87]
- BG (1995): Erste Hilfe I u. II, Taschenbuch für
Sicherheitsbeauftragte, Metall, arbeitsgemeinschaft der
Metall-Berufsgenossenschaften, S. 146 u. 152
|
|
|
|
|
|
[88]
- Hopf-Seidel, P. (2006): Die persistierende Borreliose - Klinik,
diagnostisches Procedere und ein ganzheitliches Behandlungsregime
dieser Multiorganerkrankung / Die persistierende Borreliose ist
eine Multiorganerkrankung und deshalb kommt der Anamnese und
körperlichen Untersuchung zur Erkennung dieser Erkrankung
eine ganz wesentliche Bedeutung zu, Vortrag von: Dr. Petra
Hopf-Seidel, Fachärztin für Neurologie, Psychiatrie,
Allgemeinmedizin mit Zusatz bez. Chirotherapie, S. 1-17, Stand
04/06
|
|
|
|
|
|
[89]
- DGfN (2006): Neuroborreliose, Leitlinien, Deutsche Gesellschaft
für Neurologie, www.dgn.org/106.0.html
|
|
|
|
|
|
[90]
- Jahraus, O. (2002): Identifizierung und Charakterisierung neuer
Impfstoffkandidaten zum Schutz gegen die Lyme-Borrelien,
Dissertation, Biologie, Naturwissenschaftlich-Mathematischen
Gesamtfakultät der Ruprechts-Karls-Universität
Heidelberg,
http://arciv.ub.uni-heidelberg.de/volltextserver/2002/1942/pdf/Dissertation.pdf
|
|
|
|
|
|
[91]
- Labor 28 (2004): Neu Entwicklung für die
Borreliose-Diagnostik, LaborInfo 115, Analytik, Laborinformation,
Laborgemeinschaft Berlin - Labor 28 Mangement GmbH
|
|
|
|
|
|
[92]
- Schindler, R. (2004): Real Time RT-PCR for tracing and
quantification of Borna Disease Virus RNA in diseased hosts
compared to experimentally inoculated ticks,
www.dissertation.unizh.ch/2004/schindler/abstract.html
|
|
|
|
|
|
[93]
- everth (2002): www.everth.de/assets/images/pathomechanismen.pdf
|
|
|
|
|
|
[94]
- Hartmann, F., Müller-Marienburg, H. (2004): Zecke >
Spirochäte > Neurotoxin > Zytokine > Entzündung,
www.borrelioseweb.de/hartmann-neurotoxin.pdf
|
|
|
|
|
|
[95]
- Brockmann, S. (2001): Chlamydien pneumoniae - Ein Erreger
chronischer, extrapulmonaler Infektion? Chlamydiensyndrom, Archiv
- Artikel, Medizin, Deutsches Ärzteblatt 98, Ausg. 17, S.
A-1135 / B-969 / C-909, aerzteblatt.de
|
|
|
|
|
|
[96]
- Lehmann, H. (2003): Arthritiden im Kindesalter erkenn und
richtig behandeln, Rheumatische Erkrankungen, Fortbildung,
Pädiatrie hautnah, S. 228-232,
www.paediatrie-hautnah.de/arciv/2003/05/ph0305_228.pdf
|
|
|
|
|
|
[97]
- Zebandt, S. (2001): Etablierung und Evaluierung zweier IgG
Subklassen - ELISA für die Borreliose - Diagnostik beim
Menschen, Dissertation, Zentrum für Neurologie und
Neurochirurgie, Justus-Liebig-Universität Gießen,
http://geb.uni-giessen.de/geb/volltext/2001/444/pdf/d010046.pdf
|
|
|
|
|
|
[98]
- Hamid, H.M. (2000): Lipide von Borrelia burgdorferie,
Inangural-Dissertation, Zentrum für Medizinische
Mikrobiologie und Virologie, Institut für Medizinische
Mikrobilologie d. Justus-Liebig-Universität Giessen
|
|
|
|
|
|
[99]
- Burrascano, S. (2005): Advanced Topics in Lyme-Disease,
Diagnostic hints and Treatment Gudelines for Lyme and other
Tickborne illnesses, Fifteenth Editition, Eastend Medical
Associates, P.C., East Hampton, NY, International Lyme Associated
Diseases Society
|
|
|
|
|
|
[100]
- Medizinisches Labor Bremen (2006): CD57-Test bei chronischer
Lyme-Borreliose, Neuigkeiten 08.03.06, Medizinisches Labor Bremen
|
|
|
|
|
|
[101]
- Opladen, T. (2002): Untersuchung zu Veränderungen der
Lymphozytensubpopulation im Krankheitsverlauf der Mukoviszidose,
Dissertation, Medizinischen Fakultät der
Rheinisch-Westfälischen Technischen Hochschule Aachen
|
|
|
|
|
|
[102]
- Ikinicioqullari, A., Kendirli, T., Dogu, F., Egin, Y., Reisli,
I., Cin, S., Babacan, E. (2004): Pripheral blood lymphozyte
subsets in healthy Turkish children, Department of Pediatric
Immunology and Allergy, Ankara University, Faculty of Medicine,
Ankara, Turkey, Apr-Jun; 46(2), S. 125-130
|
|
|
|
|
|
[103]
- Hartmann, K., Corvey, C., Skerka, C., Kirschfink, M., Karas, M.,
Brade, V., Miller, JC., Stevenson, B., Wallich, R., Zipfel, PF.,
Kraiczy, P. - (2006): Funktional characterization of BbCRASP-2, a
distinct outer membrane protein of Borrelia burgdorferi that binds
host complement regulators factor H and FHL-1., Institut of
Medical Microbiology, Universität Hospital of Frankfurt,
Frankfurt, Germany, Mol. Microbiol., Sep; 61(5), S. 1200-1236
|
|
|
|
|
|
[104]
- Cordes, FS., Kraiczy, P., Roversi, P., Simon, MM., Brade, V.,
Jahraus, O., Wallis, R., Goodstadt, L., Ponting, CP., Skerka, C.,
Zipfel, PF., Waillich, R., Lea, SM. (2006): Structure-function
mapping of BbCRASP-1, the kay complement factor H and FHL-1
binding protein of Borrelia burgdorferi, Laboratory of Molecular
Biophisics, Department of Biochemistry, University of Oxford,
Oxford, Int. J. Med. Microbiol., May; 296 Suppl 40, S. 177-184
|
|
|
|
|
|
[105]
- Stricker, RB., Winger, EE. (2001): Decreased CD57 lymphocyte
subset in patients with chronic Lame disease, California Pacific
Medical Center, San Francisco, USA, Immunol. Lett., Feb. 1; 76(1),
S. 43-48
|
|
|
|
|
|
[106]
- Stricker, RB., Burrascano, J., Winger, E. (2002): Longterm
decrease in the CD57 lymphocyten subset in a patient with chronic
Lyme disease, California Pacific Medical Center, San Francisco,
USA, Ann. Agric Environ Med., 9(1), S. 111-3
|
|
|
|
|
|
[107]
- Andrejewski, A., Wozniakowska-Gesicka, T., Wisniewska-Ligier,
M., Wroblewska, W. (2000): Immunologic disorders in children with
Lyme borreliosis, Instytutu Cenetrum Zdrowia Matki Polki w Lodzi,
Pol. Merkuriusz Lek., Jan. 7(43), S. 34-36
|
|
|
|
|
|
[108]
- Rosaschino, F., Salvini F., Torre, R., Cisarri, G., Oleari, F.
(1994): Evaluation of the immune status of children never treated
with chemoantibiotics (Children 3 to 6 years old), Universta degli
Studi di Milano, Instituto di Pediatria, Minerva Pediatr., Nov.,
46(11), S. 481-500
|
|
|
|
|
|
[109]
- Schoenen, J., Sianard-Gainko, J., Carpentier, M., Reznik, M.
(1989): Myostis during Borrelia burgdorferi infection (Lyme
disease), Department of Neurology, University of Liege, Belgium,
J. Neurol. Neurosurg Psychiatry, Aug; 52(8), S. 1002-5
|
|
|
|
|
|
[110]
- Armstrong, AL., Barthold, SW., Persing, DH., Beck, DS. (1992):
Carditis in Lyme disease susceptible and resistant strains of
laboratory mice infected with Borrelia burgdorferie, Section of
Comparative Medicine, Yale University School of Medicine, New
Haven, Connecticut, Am. J. Trop. Med. Hyg., Aug; 47(2), S. 249-58
|
|
|
|
|
|
[111]
- Wang, G., Ojaimi, C., Iver, R., Saksenberg, V., Mc Clain, SA.,
Wprmser, GP., Schwartz, I. (2001): Impact of genotypic variation
of Borrelia burgdorferi sensu stricto on kinetics of dissemination
and severity of disease in C3H/HeJ mice, Department of
Biochemistry and Molecular Biology, Department of Medicine, New
York Medical College, New York, USA, Infect Immun., Jul; 69(7), S.
4303-12
|
|
|
|
|
|
[112]
- Wilhelm, K. (2006): Großangriff auf die Malaria –
Lange Zeit haben die Industrieländer kaum Medikamente gegen
die Malaria entwickelt. Jetzt stellen sie Geld bereit – und
haben neue Erfolge versprechende Wirkstoffe in der Pipeline., bild
der wissenschaft, Verl. Konradin Medien GmbH, S. 26-33, 10/06
|
|
|
|
|
|
[113]
- EBI (2006): EMBL Nucleotid Reihenfolge Datenbank, EBI Netzwerk
Dienste, europäische Bioinformatics Institut, 23.09.06,
http://genius.embnet.dkfz-heidelberg.de/menu/cgi-bin/srs/wgetz?-newid+-e+[EMBL-ID:AE001584]
|
|
|
|
|
|
[114]
- Jaenicke, L. (2004): Acylierte Cholesterolgalactoside zur
Differentialdiagnose des Lyme-Disease, Rundschau, Journal-Club,
BIOspektrum 4/04, 10. Jg., S. 370
|
|
|
|
|
|
[115]
- Straubinger, R. K. (2002): Auf dem Weg von der Spirale zur Zyste
– Mögliche Überlensstrategie von Borrelia
burgdorferi, Biotechnologisch-Biomedizinisches Zentrum Universität
Leipzig, www.uni-leipzig.de/bbz/dateien/campus02_straubinger.PDF
|
|
|
|
|
|
[116]
- Wallich, R. (2006): Charakterisierung neuer Borrelia
burgdorferie Antigene für die Impfstoffentwicklung und
Untersuchungen zu Pathogenese der Lyme Borreliose, Aktuelle
Forschungsprojekte der Arbeitsgruppe Infektionimmunologie,
Arbeitsgruppe Infektionsimmunologie, UniversitätsKlinikum
Heidelberg,
www.klinikum.uni-heidelberg.de/Infektionsimmunologie.2834.0.html
|
|
|
|
|
|
[117]
- Diaz, E., Papa, A., Vezyri, E., Tsounis, S., Milonas, I. u.
Antoniadis, A.): Borrelia valaisiana in cerebrospinal fluid,
Emerging Infections Diseases, Sep. 2004,
www.findarticles.com/p/articles/mi_m0GVK/is_9_10/ai_n6211054
|
|
|
|
|
|
[118]
- Foldvari, R., Farkas, R. u. Lakos, A. (2005): Borrelia
spielmanii erythema migrans, Hungary, Emerging Infections
Diseases,
www.findarticles.com/p/articles/mi_m0GVK/is_11_11/ai_n15796075
|
|
|
|
|
|
[119]
- Bunikis, J., Tsao, J., Garpmp, U., Brglund, J., Fish, D. u.
Barbour, A.-G. (2004): Typing of Borelia relapsing fever group
strains, Sep. 2004, Emerging Infections Diseases,
www.findarticles.com/p/articles/mi_m0GVK/is_9_10/ai_n6211043
|
|
|
|
|
|
[120]
- Loebermann, M., fingerle, V., Lademann, M., Fritzsche, C. u.
Reisinger, E.-C. (2006): Borrelia burgdorferi and Anaplasma
phadocytophilum Coinfection, Feb. 2006, Emerging Infectious
Diseases,
www.findarticles.com/p/articles/mi_m0GVK/is_2_12/ai_n16107510
|
|
|
|
|
|
[121]
- Bunikis, J., Barbour, A. G. (2005): Third Borrelia species in
white-footed mice, Emerging Infectious Diseases,
www.findarticles.com/p/articles/mi_m0GVK/is_7_11/ai_n14787819
|
|
|
|
|
|
[122]
- Paulus, J. (2007): Wie entstehen Geisteskrankheiten / Gene,
Moleküle oder überfürsorgliche Mütter? Für
viele Erkrankungen des Geistes fehlen befriedigende Erklärungen.,
Die 7 Rätsel der Hirnforschung, Leben & Umwelt, Bild der
Wissenschaft, Verl. Deutsche Verlags-Anstalt GmbH - Stuttgart,
S.35-36, J. 1/07
|
|
|
|
|
|
[123]
- Sivers, M. (2006): Die Erreger der Lyme-Borreliose in Kultur,
Transfer, Hochschule Wädenswil – Kompetenzzentrum für
Life Siences und Facility Management, S. 2-3, H. Nr. 3, Dez. 2006
|
|
|
|
|
|
[124]
- MacDonald, A, B (2006): Dementia caused by Borrelia infection of
the Central Nervous System, Columbia University LDA National
Scientific Meeting, Philadelphia Pennsylvania, 20.10.2006
|
|
|
|
|
|
[125]
- Butovsky, O., Gennady, L., Kunis, G., Ziv, Y., Avidan, H.,
Greenberg, N., Schwartz, A., Smirnov, I., Pollack, A., Jung, S. u.
Schwartz, M. (2006): Induction and blockage of oligodendrogenesis
by differently activated microglia in an animal model of multiple
sclerosis, JCI / The Journal of Clinical Investigation, Published
Online March 23, 2006, www.jci.org/cgi/contant/abstract/JCI26836v1
|
|
|
|
|
|
[126]
- MacDonald, A, B (2006): Dementia caused by Borrelia infection of
the Central Nervous System, Columbia University LDA National
Scientific Meeting, Philadelphia Pennsylvania, 20.10.2006,
www.molecularalzheimer.org/files/Final_version_Philadelphia_Presentation.pdf
|
|
|
|
|
|
[127]
- Frey, U., Retz, W., Riederer, P., Rösler, M. (2000):
Aspekte in der antidementiven Pharmakotherapie der Alzheimer -
Erkrankung, Aktuelle Neurobiologie, Verl. Georg Thieme Verlag -
Stittgart, Band 27, S. 305-317, J. 2000
|
|
|
|
|
|
[128]
- Evert, U., Weller, U., Waldher, A. (2005): Borreliose-Serologie,
Deutesch Version des Posters anlässlich des Internationalen
Potsdam-Symposiums VIII in Jena, 3/05, Laborzentrum Berlin,
http://www.evert.de/Uta_/Borreliose-Serologie.pdf
|
|
|
|
|
|
[129]
- Donner, S. (2007): Die Macht der Mütter / Menschen sind
weit mehr das Ebenbild ihrer Gene. Schon kurz nach der Befruchtung
beginnt der Körper der Mutter das Kind zu progammieren., Bild
der Wissenschaft, Verl. Konradin Medien GmbH,
Leinfelden-Echterdingen, S.19-23, J. 3/07, ISSN 0006-2375
|
|
|
|
|
|
[130]
- Straubinger, R. K., (2003): Was klinische Veränderungen uns
über die Pathogenese der Lyme-Borreliose verraten, Vom
Patienten zum Molekül, 2. Biotechnologie-Tag an der
Universität Leipzig, 21.05.03, Herausgeber: Pepp, H.,
Beck-Sickinger, A.G., Eichler, S., S. 52-53,
www.uni-Leipzig.de/bbz/dateien/abstract_2003.pdf
|
|
|
|
|
|
[131]
- Al-Rabay, S., Straubinger, R. K. (2003): The role of cyst
formation for the survival of Borrelia burgdorferi organismus,
Grundlagen, 2. Biotechnologie-Tag an der Universität Leipzig,
21.05.03, Herausgeber: Pepp, H., Beck-Sickinger, A.G., Eichler,
S., S. 58-59, www.uni-Leipzig.de/bbz/dateien/abstract_2003.pdf
|
|
|
|
|
|
[132]
- Treib, J. (1999): Borreliose und FSME bei Kindern,
Kongresbericht, Medizin, Deutsches Ärzteblatt 96, H. 45,
12.11.99, A-2905, www.ärzteblatt.de/v4/archiv/pdf.asp?d=199913
|
|
|
|
|
|
[133]
- Soulas, P., Woods, A., Janlhac, B., Knapp, A.-M., Paspuali,
J.-C., Martin, T. u. Korganow, A.-S. (2005): Autoantigen, innate
immunity, and T cells cooperate to break B cell tolerance during
bacterial infection, JCI / J. clin. Invest., 115: 2257-2267
(2005).doi: 1172/JCI 124646,
www,jci.org/cgi/content/abstarct/115/8/2257
|
|
|
|
|
|
[134]
- Klug, B. (2006): Anpassung von Borrelia afzelii und Borrelia
burgdorferi sensu stricto, Errger der Lyme-Krankheit, an
verschiedene Nagetier-Reservoiwirte., Digitale Dissertation,
Fachbereich Humanmedizin, Frei Universität Berlin,
www.diss.fu-berlin.de/2006/110/index.html
|
|
|
|
|
|
[135]
- Wort & Bild Verl. (2007): Schutz in Eigenregie / Röntgenpass
- Das Dokument kann helfen, unnötige Strahlenbelastungen zu
vermeiden. Darum kümmern sollte sich jeder selbst, , Aktuell,
Brennpunkt, Apotheken Umschau + Gesundheit, 15. August 2007 B,
Wort & Bild Verlag, Konradshöhe, 82065 Baierbrunn, S. 8
u. 9
|
|
|
|
|
|
[136]
- Berner, R. (2003): Borrelien-Nachweis in Zecken („Zecken-PCR“),
Zecken-übertragene Erkrankungen, Zentrum für
Kinderheilkunde und Jugendmedizin, Universität Freiburg,
http://www.daer.de/html/kongresse/2003/
ostern/download/Infekte_3.pdf
|
|
|
|
|
|
[137]
- RKI (2007) Lyme-Borreliose: RKI-Ratgeber Infektionskrankheiten -
Merkblatt für Ärzte, FSME Impfempfehlung der STIKO,
Ratgeber Infektionskrankheiten, Epidemiologisches Bulletin Nr. 17,
Aktuelle Daten und Informationen zu Infektionskrankheiten und
Public Health, Aktualisierung vom April 2007; Erstveröffentlichung
im Epidemiologischen Bulletin 22/1999, Robert Koch Institut / RKI,
S. 148-150, http://www.rki.de
|
|
|
|
|
|
[138]
- Straubinger, R. (2006): >>Spirochäteninfektion unter
besonderer Berücksichtigung der direkten
Wirt-Erreger-Kommunikation am Beispiel der Lyme-Borreliose <<,
Nachwuchsgruppe Molekulare Infektionsmedizin, Forschungsbericht -
Research Report 2006, S. 291-292,
Biotechnologisch-Biomedizinisches Zentrum, Universität
Leipzig, www.uni-leipzig.de/forschung/fkst.htm
|
|
|
|
|
|
[139]
- Fingerle, V. u. Wilske, B. (2007): Mikrobiologische Diagnostik
der Lyme-Borreliose / Microbiological diagnostics of Lyme
borreliosis, LaboratoriumsMedizin, Print ISSN: 0342-3026,
Electronic ISSN: 1439-0477, CODEN: LABOD3, Vol. 31, Issue: 3,
Cover date: June 2007, Page(s): 141-148, W DE G / de Gruyter
Berlin - New York, doi: 10.1515/JLM.2007.019,
http://www.atypon-link.com/WDG/doi/ads/10.1515/JLM.2007.019
|
|
|
|
|
|
[140]
- Lakos, A. (2005): Borrelia spielmanii erythema, Letters,
Emerging Infectious Diseases, TheFreeLibrary, Healt, 01.11.2005,
http://www.thefreelibrary.com/Borrelia+spielmanii+erythema+migrans,+Hungary-a0138659674
|
|
|
|
|
|
[141]
- Földvári, G., Farkus, R., Lakos, A. (2005): Borrelia
spielmanii Erythema Migrans, Hungary, St. István University
Faculty of Veterinary Sciens (Budapest, Hungary) and Center for
Tick-borne Disease (Budapest, Hungary), Emerging Infections
Diseases, Vol. 11, No. 11, Nov. 2005,
http://0-www-cdc.gov.mik1.sjiibrary.org/neidod/oid/vol11no11/05-0542.htm
|
|
|
|
|
|
[142]
- Fingerle V., Schulte-Spechtel U., Ruzic-Sabljic E., Strle F.,
Leonhard S., Hoffmann H., Weber K., Pfister K., Wilske B. Fingerle
V., Schulte Spechtel U., Ruzic - Sabljic E., Strle F., Leonhard
S., Hoffmann H., Weber K., Pfister K., B. Wilske (2007):
Epidemiological aspects of Borrelia spielmanii from Germany with
special respect to its genetic heterogeneity Epidemiologischen /
Aspekte von Borrelien spielmanii aus Deutschland unter besonderer
Berücksichtigung ihrer genetischen Heterogenität, ESCMID
- European Society of clinical Mikrobiology and infections
Diseases, 17th European Congress of Clinical Microbiology and
Infectious Diseases / 17. Europäischer Kongress für
Klinische Mikrobiologie und Infektionskrankheiten, ICC, Munich,
Germany, 31 Mar - 04 Apr 2007 ICC, München, Deutschland, 31
Mar - 04 Apr 2007
|
|
|
|
|
|
[143]
- Blessing, F., Herbeck, H., Blessing, J. (2007): FSME und
Borreliose - die klinisch bedeutendsten zeckenvermittelten
Infektionskrankheiten im europäischen Raum, Fortbildung,
Ärzteblatt Baden-Württemberg, ÄBW 09-2007, S.
456-460 (Page 10-15), 10 /2007,
http://www.aerztekammer-bw.de/aerzteblatt/Homepage/aktuell/0508_k.pdf
|
|
|
|
|
|
[144]
- Leitritz (2004): Verschlüsselung von Infektionskrankheiten
und Infektionserregern, Kodierleitfaden 2004, erstellt von der DRG
AG der DGHM in Zusammenarbeit mit GfV, BÄMI, DGIM, DGI, DGPI,
PEG, DAIG, DGKH, DGKL, DmykG, AKM und NRZ für Borrelien,
Version 012, 20.08.2004, DRG-prakt-2004-012.doc,Leitritz(pdf)
|
|
|
|
|
|
[145]
- Herzberger P, Siegel C, Skerka C, Fingerle V, Schulte-Spechtel
U, van Dam A, Wilske B, Brade V, Zipfel PF, Wallich R, Kraiczy P.
(2007) Human pathogenic Borrelia spielmanii sp. nov. resists
complement-mediated killing by direct binding of immune regulators
factor H and factor H-like protein 1., Institute of Medical
Microbiology and Infection Control, University Hospital of
Frankfurt, Paul-Ehrlich-Str. 40, D-60596 Frankfurt, Germany.,
Infect Immun, A service of the National Library of Medicine and
the National Institutes of Health / NCBI PubMed, 2007
Oct;75(10):4817-25. Epub 2007 Jul 16.
|
|
|
|
|
|
[145]
- TK Redak. (2007): Ökonomie für eine rationale Medizin
- Mehr Ausgaben bedeuten nicht mehr Gesundheit, Beitag von Prof.
Dr. h.c. Peter Oberender (Forschungsstelle für Sozialrecht
und Gesundheitsökonomie, Uni Bayreuth) auf Tagung der
TK-Selbstverwaltung, TK Aktuell, Nr. 4 / 2007, S. 9, C3571,
Techniker Krankenkasse, Hauptverwaltung, Bereich Marketing und
Vertrieb, Fachbereich Werbung, Internet, Vollmer-Rupprecht, R.,
Bramfelder Str. 140, 22305 Hamburg
|
|
|
|
|
|
[146]
- LG OS (2005): 1. Die Klage wird abgewiesen., 2. Der Kläger
trägt die Kosten des Rechtsstreits., 3. Das Urteil ist gegen
Leistungen einer Sicherheit in Höhe von 110% des
beizutreibenden Betrages vorläufig vollstreckbar,
Urteilsverkündung am: 30.11.2005, Geschäfts-Nr.: 2 O
3380/03, Landgericht Osnabrück,
http://app.lg-os.niedersachsen.de/landgericht/Entscheidungen/FILES/2O338003.htm
|
|
|
|
|
|
[147]
- Jentsch, E. (2007): Jede Zecke wird auf Borrelien untersucht,
Deutsches Ärzteblatt 104, Ausgabe 40 vom 05.10.2007, Seite
A-2720 / B-2402 / C-2329
|
|
|
|
|
|
[148]
- Pachner, A. R., Dail, D., Yunhong, B., Sondey, M., Pak, L.,
Narayan, K., Cadavid, D. (2004): Genotypus bestimmt Phänotyp
in Lyme-Borreliose Experimenten, Ann. Neurol. 2004, Sep; 56(3):
361-70, PMID-15349863, OWN-NLM, STAT-in-process, DA-20040906,
IS-0364-5134 ausgedr. VI-56, IP-3, DP-2004 Sep PG - 361 - 70
|
|
|
|
|
|
[149]
- Stümpert, F. (2007): Der „Unfall Zeckenbiss“,
Wissenswertes rund um Versicherung - Vorsorge - Vermögen, Für
unsere Kunden, Allianz, Winter 2007, www.allianz-stuempert.de
|
|
|
|
|
|
[150]
- Spork, P. (2007): Gen an, Gen aus / Die Epigenetik zeigt:
DNA-Abschnitte sind ein Lben lang formbar - ob wir rauchen oder
uns gesund ernähren entscheidet darüber mit, ob wir sie
aktivieren oder nicht, Wissen & Bildung, Frankfurter
Rundschau, S. 14 u. 15., Do. 13.12.07, 63. Jg., Nr. 290, D/R/S
|
|
|
|
|
|
[151]
- Hartmann, F., Müller-Marienburg, H. (2008) Borreliose, Zur
Entstehung und Behandlung der Borreliose, 3., durchgesehene
Auflage, Ansbach 2008, Druck: hansadruck Kiel
|
|
|
|
|
|
[152]
- Schmidt, F.-P., von Baehr, V., Gaida, B., Hugo, F., Andressohn,
P., Tregel, M., Endres, A.-S. (2007): Was kann die HLA-Bestimmung
bei der Diagnostik und Beurteilung des Verlaufes einer Borreliose
leisten?, Diagnostik-Info 214 , Ärzte für Labormedizin (
Mikrobiologie / Infektionsepidemiologie / Transfusionsmedizin /
Hämostaseologie - Institut für Medizinische Diagnostik,
05.09.2007
|
|
|
|
|
|
[153]
-Schmidt, F.-P., von Baehr, V., Gaida, B., Hugo, F., Andressohn,
P., Tregel, M., Endres, A.-S. (2007): Das HLA-System und
Krankheitsassoziationen, Diagnostik-Info 209 , Ärzte für
Labormedizin ( Mikrobiologie / Infektionsepidemiologie /
Transfusionsmedizin / Hämostaseologie - Institut für
Medizinische Diagnostik, 19.09.2007
|
|
|
|
|
|
[154]
-Schwarzbach, A. (2008): 3 Kasuistiken sinnvoller diagnostischer
Strategien bei frischer und chronischer Borreliose, Vortrag,
18.04.2008, DBG / Deutsche Borreliose-Gesellschaft e.V. -
vereinigt Wissenschaftler und Ärzte, die sich
mit der Borreliose und assoziierten Infektionskrankheiten
befassen, Jahresversammlung, Goslar-Hahnenklee 18.-19.
April 2008
|
|
|
|
|
|
[155]
- Meer-Scherrer, L. (2008): Therapiekonzepte der Borreliose im
Wandel der Zeit 25 Jahre Erfahrung - Rückblick und Ausblick
in Praxis und Forschung, Vortrag, 18.04.2008, DBG / Deutsche
Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Goslar-Hahnenklee 18.-19. April 2008
|
|
|
|
|
|
[156]
- Baehr, R. von (2008): Immunologie der Borrelien-Infektion,
Vortrag von Prof. Dr. med. R. von Baehr - Immunologe, 19.04.2008,
DBG / Deutsche Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Goslar-Hahnenklee 18.-19. April 2008
|
|
|
|
|
|
[157]
- Berghoff, W. (2008): Liquordiagnostik, Vortrag von PD Dr. med.
W. Berghoff - FA f. Innere Medizin, 18.04.2008, DBG / Deutsche
Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Goslar-Hahnenklee 18.-19. April 2008
|
|
|
|
|
|
[158]
- Neubert, U. (2008): Hautmanifestationen der Lyme-Borreliose,
Vortrag von Akad. Dir. i.R. Dr. med. U. Neubert - FA f.
Dermatologie, 19.04.2008, DBG / Deutsche Borreliose-Gesellschaft
e.V. - vereinigt Wissenschaftler und Ärzte, die
sich mit der Borreliose und assoziierten Infektionskrankheiten
befassen, Jahresversammlung, Goslar-Hahnenklee 18.-19.
April 2008
|
|
|
|
|
|
[159]
- Lorenz, M. (2008): Neuroborreliose und psychiatrisches Syndrom,
Vortrag von M. Lorenz FA f. Neurologie u. Psychiatrie, 19.04.2008,
DBG / Deutsche Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Goslar-Hahnenklee 18.-19. April 2008
|
|
|
|
|
|
[160]
- Grossmann, W. (2008): Diagnose chronischer entzündlicher
Prozesse im Bewegungsapparat, Nervensystem und Vegetativum als
Hinweis auf eine borrelieninduzierte Intoxikation, Vortrag,
19.04.2008, DBG / Deutsche Borreliose-Gesellschaft e.V. -
vereinigt Wissenschaftler und Ärzte, die sich
mit der Borreliose und assoziierten Infektionskrankheiten
befassen, Jahresversammlung, Goslar-Hahnenklee 18.-19.
April 2008
|
|
|
|
|
|
[161]
- Carreivo, M.M., Laux, D.C. u. Nelson, D.R. (1990):
Characterization of the heat shock response and identification of
heat shock protein antigens of Borrelia burgdorferi, Department of
Microbiology, University of Rhode Island, Kingston 02881, Infect
Immun, 7/90;58(7)2186-91
|
|
|
|
|
|
[162]
- Deutsche Borreliose-Gesellschaft e.V. (2008): Therapie
der Borreliose, Diagnostik und Therapie der Lyme-Borreliose /
2008, Empfehlungen der Deutschen Borreliose-Gesellschaft, Von
einer Arbeitsgruppe der Deutsche Borreliose-Gesellschaft e.V. (von
Baehr, R., Hartmann, F., Heesch, W., Herrmann, G., Hopf-Seidel,
P., Huismans, B.-D., Klemann, W., Neubert, U., Roezinski, A.,
Schwarzbach, A., Weitkus, B., Viebahn, J. u. Voss, P.), 12. April
2008
|
|
|
|
|
|
[163]
- von Baehr, R. (2008): Empfehlungen zur situationsgerechten
Labordiagnostik der Borreliose (Diskussionsstand vom 23.11.2007),
von der DBG e.V. - arbeitsgruppe Labordiagnostik, Sprecher: Prof.
Dr. med. Rüdiger von Baehr, Labor + Diagnostik, Borreliose
Wissen aktuell, Nr. 17, S. 3-4, Februar 2008, Borreliose und FSME
Bund Deutschland - Patientenorganisation Bundesverband
|
|
|
|
|
|
[164]
- Schwarzbach, A. (2008): Borrelien-Elispot / Aktuelle
Aktivitätsmessung im Blut gegenüber Borrelia
burgdorferi, Labor + Diagnostik, Borreliose Wissen aktuell, Nr.
17, S. 23, Februar 2008, Borreliose und FSME Bund Deutschland -
Patientenorganisation Bundesverband
|
|
|
|
|
|
[165]
- Donta, et al. (2003): United States Patent 6,667,038,
December 23, 2003, Prevention, diagnosis and treatment of lyme
disease,
Http://patft.uspto.gov/natacgi/nph-Parser?Sect1=PTO2&Sect2=HITOFF&p=1&u=/netahtml/search
-ool.html&r=1&f=G&J=50&co1=AND&d=ptxt&s1=Bbtox&OS=BBtox&RS=Bbtox
|
|
|
|
|
|
[166]
- Donta, S. T., Cartwright, M. J. (2008): Prevention, diagnosis
and treatment of lyme diseas / US Patent Issued on December 23,
2003, Assignee: Boston Medical Center Corp., Application: No.
553863 filed on 2000-04-20, Current US Class: 424/190.1,
PatentStorm, Pierce School Lofts, 1375 Maryland Ave., NE Loft B,
Washington, DC 20002,
http://www.patentstorm.us/patents/6667038-description.html
|
|
|
|
|
|
[167]
- Carwright, M. J., Martin, S. E., Donta, S. T. (2002): A Novel
Toxin (Bb Tox 1) of Borrelis burgdorferi, Boston University
Medical Center, Boston VA Medical Center, 88 East Newton Street,
E-639, Boston, MA 02118, Med Clin North Am. 86:341-9, 2002,
http://www.actionlyme.org/Donta.htm
|
|
|
|
|
|
[168]
- Donta, S. T., (2002): 6667038
Prevention, diagnosis and treatment of lyme disease, Abstract: The
present invention provides compositions and methods related to
Borrelis burgdorferi toxin and antitoxin preparation. In
particuklar, the present invention provides methods and
compositions for the diagnosis of Lyme disease, as well as for use
in tresting subjected infected with B. Burgdorferi through passive
immunization, and vaccine development., Date Issued: December 23,
2003, Application: 09/553,863, Fied: April 20, 2000, Inventors:
Carwright, M. J. (West Newton, MA), Donta,
S. T. (Boston, MA), Primary Examiner: Swartz, R. P., U.S. Patent
Documents: 5530103, Other References: Fraser, et al, Genomic
Sequence of a Lyme Disease Spirochaete..., Accession No. B70194,
1997, patentgenius,
http://www.patentgenius.com/patent/6667038.html
|
|
|
|
|
|
[169]
- Grossmann, W., Bachmann, C. (2008): Diagnose chronisch
entzündlicher Prozesse im Bewegungsapparat, Nervensystem und
Vegetativum als Hinweis auf eine borrelioseinduzierte
Intoxikation, Vortrag, 19.04.2008, DBG / Deutsche
Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Goslar-Hahnenklee 18.-19. April 2008
|
|
|
|
|
|
[170]
- Peter, L. (2008): Biowaffen gegen Zecken / Zecken können
nich nur Hirnhautentzündung übetragen, sondern auch die
gefährliche Lyme-Borreliose, gegen die es bislang keinen
Impfstoff gibt. Jetzt bekämpfen Biologen die Blutsauger mit
Pilzen, Wespen und Weidetieren., Borreliose, Bild der
Wissenschaft, Konradin Medien GmbH, Leinfelden-Echterdingen S.
26-31, J. 4/08, ISSN 0006-2375
|
|
|
|
|
|
[171]
- Kuhn, N. (2004): MS-Patienten aus ihrer Isolation geholfen - Der
Multiple Sklerose-Forscher und Neurologe Helmut Bauer wird am
Mittwoch 90 Jahre alt., Wissenschaft & Wetter, Göttinger
Tageblatt, S. 32, Sonnabend, 27.03.2004
|
|
|
|
|
|
[172]
- nik (2004): Symposium zur Eröffnung / Deutschlands erste
Institut für Multiple-Sklerose-Forschung, Wissenschaft &
Wetter, Göttinger Tageblatt, S. 32, Sonnabend, 27.03.2004
|
|
|
|
|
|
[173]
- z.B.: http://de.wikipedia.org/wiki/Tuskegee-Syphilis-Studie
|
|
|
|
|
|
[174]
- Siegmund-Schultze, N. (2007): Infektion nach Zeckenstich:
Zweifelhafte Borreliose-Tests, Medizireport, Deutsches Ärzteblatt
2007, Jg. 107, H. 26, A-1891,
http://www.aerzteblatt.de/v4/arciv/artikel.asp?id=56172
|
|
|
|
|
|
[175]
- Groth, H. (2008): Hautfreundlicher Schutz vor Insekten,
Krankheitsüberträger, Bild der Wissenschaft, Konradin
Medien GmbH, Leinfelden-Echterdingen, S. 8, J. 6/08, ISSN
0006-2375
|
|
|
|
|
|
[176]
- jes (2008): Wirtschaft stiftet Ostasien-Professur - fünf
Unternehmen beteiligt / Figura: „Wichtiges Signal für
Universität“, Wirtschaft & Wetter, Göttinger
Tageblatt, S. 32, 17.05.2008
|
|
|
|
|
|
[177]
- Leppert, G. (2008): Forschung, gestiftet An der Frankfurter
Universität zahlen Unternehmen für Professoren und lösen
Streit aus, wann die Freiheit der Wissenscht in Gefahr gerät.
/ Doppelter Coup für die Uni - Aventis Foundation stiftet
zwei Professuren., Thema des Tages, Frankfurter Rundschau, Jg. 64,
Nr. 105, S. D2, 06.05.2008
|
|
|
|
|
|
[178]
- Lehmhöfer, A. (2008): Forschung, gestiftet An der
Frankfurter Universität zahlen Unternehmen für
Professoren und lösen Streit aus, wann die Freiheit der
Wissenscht in Gefahr gerät. / Kuckuckseier - Die große
Zahl der Stiftungsprofessuren in Frankfurt birgt Zündstoff,
Thema des Tages, Frankfurter Rundschau, Jg. 64, Nr. 105, S. D3,
06.05.2008
|
|
|
|
|
|
[179]
- Arning, M. (2008): Forschung, gestiftet An der Frankfurter
Universität zahlen Unternehmen für Professoren und lösen
Streit aus, wann die Freiheit der Wissenscht in Gefahr gerät.
/ Gezielte Impulse - Stiftungen agiern nicht selten an den
Leerstellen der Politik, Thema des Tages, Frankfurter Rundschau,
Jg. 64, Nr. 105, S. D3, 06.05.2008
|
|
|
|
|
|
[180]
- Richter, D., Schlee, D. B., Allgöwer, R., Matuschka, F.-R.
(2004): Relationships of a Noval Lyme Disease Spirochete, Borrelia
spielmani sp. Nov., with Its Hosts in Central Europe, Abteilung
Parasitologie, Institut für Pathologie, Charité,
Humboldt-Universität zu Berlin, Berlin, Germany, Received 25
March 2004 / Accepted 29 June 2004, American Society for
Microbiology, Applied and Environmental Microbiology, Nov. 2004,
p. 6414-6419, 0099-2240/S08.00+0 DOI:
10.1128/AEM.70.11.6414-6419.2004,
http://aem.asm.org/cgi/reprint/70/11/6414.pdf
|
|
|
|
|
|
[181]
- Richter, D., Postic, D., sertour, N., Livey, I., Matuschka,
F.-R., Baranton, G. (2006): Delineation of Borrelia burgdorferi
sensu lato species by multilocus sequence analysis and
confirmation of the delineation of Borrelia spielmani sp. nov.,
International Journal of Systematic and Evolutionary Microbiology
56 (2006), 873-881; DOI 10.1099/ijs.0.64050-0, International Union
of Microbiological Societies, TRY / Journal of Clinical
Microbiology Online,
http://ijs.sgmjournal.org/cgi/content/full/56/4/873?ck=nck
|
|
|
|
|
|
[182]
- Richter, D., Matuschka, F.-R. (2006): Perpetuation of the Lyme
Disease Spirochete Borrelia lusitaniae by Lizards, Abt.
Parasitologie, Institut für Pathologie, Charité
Universitätsmedizin Berlin, Berlin, Germany, Received 3
February 2006 / Accepted 26 April 2006, American Society for
Microbiology, AEM / Applied and Environmental Microbiology, July
2006, p. 4627-4632, Vol. 72, No. 7, 0099-2240/06/$08.00+0, doi:
10.1128/AEM 00285-06, TRY / Journal of Clinical Microbiology
Online, http://aem.asm.org/cgi/content/abstract/72/7/4627
|
|
|
|
|
|
[183]
- Derdáková, M., Lencákova, D. (2005):
Association of genetic variability within the Borrelia burgdorferi
sensu lato with the Ecology, epidemiology of Lyme Borreliosis in
Europe, Parasitological Institute, Slovak Academy of Sciences,
Kosice, Slovakia / Institute of Zoology, Slovak Academy of
Sciences, Bratislava, Slovakia, Review Articles - AAEM, Ann Agric
Environ Med. 2005, 12, 165-172, http://www.aaem.pl/pdf/12165.pdf
|
|
|
|
|
|
[184]
- Leonhard, S. (2005): Untersuchungen zur Häufigkeit von
Borrelia burgdorferi sensu lato, Anaplasma phagocytophilum und
Babesia spp. in Ixodes ricinus aus Bayern und baden-Württemberg,
Inaugural-Dissertation, Tierärztliche Fakultät der
Ludwig-Maximilians-Universität München, Aus dem Institut
für Vergleichende Tropenmedizin und Parasitologie der
Ludwig-Maximilians-Universität München, München,
http://edoc.ub.uni-muenchen.de/5661/1/Leonhard_Sarah.pdf
|
|
|
|
|
|
[185]
- Haes, J. A. C. (2003): Generierung eines rekombinanten
Immunoblots als Bestätigungstest einer Infektion mit Borrelia
burgdorferi, Dissertation, Aus dem Zentrum für Klinisch-
Theoretische Medizin 1 / Institut für Infektionsmedizin /
Universitätsklinikum Hamburg-Eppendorf, Fachbereich Medizin
der Uni-Hamburg,
http://deposit.ddb.de/cgi-bin/dokserv?idn=970773099&dok_var=d1&dok_ext=pdf&filename=970773099.pdf
|
|
|
|
|
|
[186]
- MIKROGEN (2007): recomLine Borrelia IgG/IGM - Immunoassay mit
rekombinant produzierten Antigen zur Bestimmung von IgG- oder
IgM-Antikörpern gegen Borrelia burgdorferi sensu stricto, B.
Garinii, B. Afzelii und B. Spielmanii in humanem Serum, Plasma
oder Liquor, Instructions for use, Gebrauchsinformation Version
gültig ab: Bez. 2007, MIKROGEN GmbH, Florianbogen 2-4,
D-82061 Neuried, http://www.mikrogen.de/download/GIRLBBDE.pdf
|
|
|
|
|
|
[187]
- Hopf-Seidel, P. (2008): Krank durch Zeckenstich - Borreliose
erkennen und wirksam behandeln, Dr. Petra Hopf-Seidel, Knaur
Taschenbuch, Juli 2008, ISBN 978-3-426-87392-2
|
|
|
|
|
|
[188]
- Lehnen-Beyel, I. (2008): Schleppend versilbert, Bild der
Wissenschaft, Konradin Medien GmbH, Leinfelden-Echterdingen, S.
106, J. 7/08, ISSN 0006-2375
|
|
|
|
|
|
[189]
- Simon, M. (2008): Lyme Borreliose: Biologie des Erregers,
Pathogenese, Immunantwort und Schutz: Fakten und Mythen, Vortrag:
18.10.2008, DBG / Deutsche Borreliose-Gesellschaft e.V. -
vereinigt Wissenschaftler und Ärzte, die sich
mit der Borreliose und assoziierten Infektionskrankheiten
befassen, Herbsttagung, BKK-Akademie Rotenburg, 18. Oktober
2008
|
|
|
|
|
|
[190]
- Miklossy, J., Kasas, S., Zurn, A. D., McCall, S., Yu, S.,
McGeer, P. L. (2008): Persisting atypical and cystic forms of
Borrelia burgdorferi and local inflammation in Lyme
neuroborreliosia, Journal of Neuroinflammation 2008, 5:40doi:
10.1186/1742-2094-5-40, www.jneuroinflammation.com/content/5/1/40
|
|
|
|
|
|
[191]
- Rauch, J. (2008): Medikamententest – Londoner Pharmaunglück
aufgeklärt, Bild der Wissenschaft, Konradin Medien GmbH,
Leinfelden-Echterdingen, S. 36, J. 9/08, ISSN 0006-2375
|
|
|
|
|
|
[192]
- Bennefeld, H. (2008): Anamnese und klinische Symptomatik,
Vortrag: 18.10.2008, DBG / Deutsche Borreliose-Gesellschaft e.V. -
vereinigt Wissenschaftler und Ärzte, die sich
mit der Borreliose und assoziierten Infektionskrankheiten
befassen, Herbsttagung, BKK-Akademie Rotenburg, 18. Oktober
2008
|
|
|
|
|
|
[193]
- Bennefeld, H. u. Heesch, W. (2008): Nachsorge –
neurologische Probleme und Rehamaßnahmen, Vortrag:
18.10.2008, DBG / Deutsche Borreliose-Gesellschaft e.V. -
vereinigt Wissenschaftler und Ärzte, die sich
mit der Borreliose und assoziierten Infektionskrankheiten
befassen, Herbsttagung, BKK-Akademie Rotenburg, 18. Oktober
2008
|
|
|
|
|
|
[194]
- ap (2008): Cannabis gegen Schmerz – Uni Bonn: Droge hilft,
Wissen & Bildung, Fankfurter Rundschau, S. 18, Mo. 15. Dez.
2008, 64. Jg., Nr. 293
|
|
|
|
|
|
[195]
- Rudenko, N., Golovchenko, M., Grubhoffer, L., James, H., Oliver
Jr. (2009): Borrelia carolinensis sp.nov. - a new (14th) member of
Borrelia burgdorferi sensu lato complex from the southeastern
United States, Jonarl of Clinical Microbiology Accepts 2009, p.
134-141, Vol. 47, No. 1, jcm.asm.org/cgi/content/abstract/47/1/134
|
|
|
|
|
|
[196]
- Picha, D., Moravcová, L., holecková, D., Zd´árský,
E., Valesová, V., Hercoqová, J., Vanousová,
D. (2008), Examination of specific DNA by PCR in patients with
different forms of Lyme borreliosis., Int. J. Dermatol., 2008 Oct;
47(10): 1004-10
|
|
|
|
|
|
[197]
- Sievers, M., Keller, P. (2008): Bestimmung geeigneter
Antibiotika gegen die Erreger der Lyme-Borreliose im
Zellkulturmodell, Hochschule Wädenswill - Institut für
Pharmazeutische Biotechnologie, Schweiz, 1/2008,
http://bsg-sw.gmxhome.de/Sievers %20AB%20im%20Zellkulturmodell.pdf
|
|
|
|
|
|
[198]
- Grossmann, W. (2008): Neuroborreliose, Schwerpunktthema
Neurroborreliose - mit Fachbeiträgen der Deutschen Borreliose
Gesellschaft e.V., Borreliose Wissen aktuell, BFBD / Borreliose u.
FSME Bund Deutschland e.V. - Patientenorganisation Bundesverband,
Prof. Dr. med. Werner Grossmann - FA f. Neurologie / Medicenter
München, Okt. 2008, Nr. 18, S. 11-14
|
|
|
|
|
|
[199]
- Hartmann, F. (2008): Die „so genannte“
Neuroborreliose, Neuroborreliose, Schwerpunktthema
Neurroborreliose - mit Fachbeiträgen der Deutschen Borreliose
Gesellschaft e.V., Borreliose Wissen aktuell, BFBD / Borreliose u.
FSME Bund Deutschland e.V. - Patientenorganisation Bundesverband,
Prof. Dr. med. Fred Hartmann FA f. Innere Medizin / Chefarzt a. D.
Ansbach, Okt. 2008, Nr. 18, S. 17
|
|
|
|
|
|
[200]
- Groth, H. (2008): Alzheimer-Medikamente zweifelhaft /
Neuroleptiker können nachteilig wirken, bdw-Nachrichten, Bild
der Wissenschaft, Konradin Medien GmbH, Leinfelden-Echterdingen S.
10, J. 7/08, ISSN 0006-2375
|
|
|
|
|
|
[201]
- Hopf-Seidel. P. (2008): Neue Wege in Diagnostik und Therapie der
chronischen Borreliose, Vortrag von Dr. med. P. Hopf-Seidel FA f.
Neurologie und Psychiatrie, 18.04.2008, DBG / Deutsche
Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Goslar-Hahnenklee 18.-19. April 2008
|
|
|
|
|
|
[202]
- Müller, K. E. (2008): Erkrankung der Sehnen und Bänder
durch Borreliose, Schwerpunktthema Neurroborreliose - mit
Fachbeiträgen der Deutschen Borreliose Gesellschaft e.V.,
Borreliose Wissen aktuell, BFBD / Borreliose u. FSME Bund
Deutschland e.V. - Patientenorganisation Bundesverband, Dr. med.
K. E. Müller - Dermatologe - Venerologie - Berufsdermatologie
- Umweltmedizin / Praxisklinik f. Umweltmedizin, Okt. 2008, Nr.
18, S. 30-31
|
|
|
|
|
|
[203]
- Szasz, P. (2008): , Aus der Laborforschung - Prof. Sievers:
Mitgliederversammlung am 5. April 2008 in Bad Soden-Salmünster
/ ausgewählte Notizen von Paul Szasz, Forschung,
Schwerpunktthema Neurroborreliose - mit Fachbeiträgen der
Deutschen Borreliose Gesellschaft e.V., Borreliose Wissen aktuell,
BFBD / Borreliose u. FSME Bund Deutschland e.V. -
Patientenorganisation Bundesverband, Okt. 2008, Nr. 18, S. 27
|
|
|
|
|
|
[204]
- Lippincot, W. (2008): Dietrich, T., Geidorfer, W.,
Schlötzer-Schrehardt, U., Holbach, L., Schoerner, C., Seitz,
B., Borrelien-assoziierte Crystalline Kreatopathy mit Intracorneal
Nachweis von Borrelia garinii durch Elektronenmikroskopie und
Polymerase-Kettenreaktion, Case Report,Corenae, 27(4): 498-500,
Mai 2008, Arciv, Cornea - The Jornal of Cornea and Exxternal
Disease, Lippincott Williams & Wilkins
|
|
|
|
|
|
[205]
- Tara, J., Moriarty, M., Norman, U., Colarusso, P., Bankhead, T.,
Kubes, P., Chaconas, G. (2008): Real-Time High Resolution 3D
Imaging of the Lyme Disease Spirochete Adhering to and Escaping
from the Vasculature of a Living Host, PloS Pathog. 2008 June;
4(6):e1000090, Published online 2008 June 20. doi:
10.1371/journal.ppat.1000090, PMCID: PMC2408724
|
|
|
|
|
|
[206]
- Faulde, M., Scharninghausen, J., Tisch, M. (2007): Preventive
effect of permethrin-impregnated clothing to Ixodes ricinus ticks
and associated Borrelia burgdorferi s.l. in Germany, Elsevier GmbH
© 2007 all rights
reserved, International Journal of Medical Microbiology, Vol. 298,
Supl. 1, Sep. 2008, S. 321-324
|
|
|
|
|
|
[207]
- Sievers, M. (2008): Borreliose - die „Lues“ (Syphilis)
der Moderne, 43. Fortbildungskongress der Ärztekammer am 26.
Januar 2008, Vortrag zum Thema von: Prof. Dr. M. Sievers,
Hochschule Wädenswill - Institut für Pharmazeutische
Biotechnologie, Schweiz, Notizen von: Szasz, P., Strayle, D. u.
Welker, C., Forschung, Schwerpunktthema Neurroborreliose - mit
Fachbeiträgen der Deutschen Borreliose Gesellschaft e.V.,
Borreliose Wissen aktuell, BFBD / Borreliose u. FSME Bund
Deutschland e.V. - Patientenorganisation Bundesverband, Okt. 2008,
Nr. 18, S. 28
|
|
|
|
|
|
[208]
- Baehr, R. von, (2008): Borreliose - die „Lues“
(Syphilis) der Moderne, 43. Fortbildungskongress der Ärztekammer
am 26. Januar 2008, Vortrag zum Thema von: Prof. Dr. med. R. Von
Baehr - Institut für Medizinische Diagnostik MVZ GbR, Berlin,
Notizen von: Szasz, P., Strayle, D. u. Welker, C., Forschung,
Schwerpunktthema Neurroborreliose - mit Fachbeiträgen der
Deutschen Borreliose Gesellschaft e.V., Borreliose Wissen aktuell,
BFBD / Borreliose u. FSME Bund Deutschland e.V. -
Patientenorganisation Bundesverband, Okt. 2008, Nr. 18, S. 28
|
|
|
|
|
|
[209]
- Paulus, J. (2005): Alzheimer: Frühe Warnsignale –
mit Hilfe neuer Tests können Wissenschaftler bei
Vergesslichkeit eine „leichte kognitive Störung“
diagnostizieren – und die ist häufiger, als Ärzte
bislang meinten, die Vorbotin einer Demenz., Bild der
Wissenschaft, Verl. Deutsche Verlags-Anstalt / Printet in Germany,
S. 72-76, J. 2/05, ISSN 0006-2375
|
|
|
|
|
|
[210]
- Zippel, H. P., Meyer, D. L., Knaust, M. (1988): Peripheral ans
central post-lesion plasticity in the olfactory system of the
goldfish: Behavior and Morphology, Post-Lesion Neural Plasticity,
Verl. Springer / Berlin / Heidelberg / New York, S. 577-591, J. 88
|
|
|
|
|
|
[211]
- Zippel, H. P. (1995): Regeneration in the Peripheral and the
Central Olfactory System: a review of morphological, physiological
and behavioral aspects, Physiologisches Institut, Georg August
Universität Göttingen, Fr. Germany, J. Hirnforschung 34,
S. 207-229, J 93
|
|
|
|
|
|
[212]
- Schwarzbach, A. (2008): Nicht alles ist Borreliose - Zunehmende
Bedeutung der Co-Infektionen, Schwerpunktthema Neurroborreliose -
mit Fachbeiträgen der Deutschen Borreliose Gesellschaft e.V.,
Borreliose Wissen aktuell, BFBD / Borreliose u. FSME Bund
Deutschland e.V. - Patientenorganisation Bundesverband, Dr. med.
A. Schwarzbach - leitender Laborarzt im Borreliose Centrum
Augsburg, Okt. 2008, Nr. 18, S. 29
|
|
|
|
|
|
[213]
- Hartmann, K. (2008): Borreliose / Lymphozyten-assoziiertes
Antigen, Infektionskrankheiten, Unterlagen Studium, Vorlesung
Innere Medizin, 6. Semester, Prof. Dr. Katrin Hartmann,
Uni-München
|
|
|
|
|
|
[214]
- Baehr, r. v., (2009): Zellulär
immunologische Methoden zur Verlaufsbeurteilung von Patienten mit
Borreliose vor und nach antibiotischer Behandlung, Institut für
medizinische Diagnostik-Berlin, Tagungsmappe der DBG 7 Deutsche
Borreliose-Gesellschaft e.V., Tabarz 20.-22.03.2009
|
|
|
|
|
|
[215]
-
Evert,
U. (2009): Kriterien analytischer Leistungsfähigkeit am
Beispiel kommerziell erhältlicher Such-Tests auf
Borrelien-Antikörper (ELISA), Vortrage auf der DBG-Tagung in
Tabarz, 22.03.2009
|
|
|
|
|
|
[216]
-
Wallich, R. (2009):
Borrelienvakzine - Stand und Perspektive, Vortrage
auf der DBG-Tagung in Tabarz, 22.03.2009, Prof.
Dr. med. Wallich, Infektionsimmunologie, Uni-Klinikum, Heidelberg
|
|
|
|
|
|
[217]
- Nagel,
F. (2006): Charakterisierung der zellulären und humoralen
Immunantwort auf VlsE im Vergleich zu anderen Borrelienproteinen
bei Kindern mit Lyme-Borreliose, Dissertation zum Erwerb
des Doktorgrades der Medizin an der Medizinischen Fakultät
der Ludwig-Maximilians-Universität zu München, München,
Deutschland
|
|
|
|
|
|
[218]
- Stütz, W. (2006): Neuroborreliose im Kindesalter –
Eine klinische und epidemiologische Charakteristik von Patienten
der Universitätsklink für Kinder- und Jugendheilkunde
Graz von 2000 bis 2006 im Vergleich mit internationalen Daten,
Diplomarbeit, Zur Erlangung des akademischen Grades „Doktor
der gesamten Heilkunde“ (Dr. med.-univ.), Matr. Nr.: 0310162,
Universitätsklink für Kinder- und Jugendheilkunde Graz
|
|
|
|
|
|
[219]
- EUCALB (Stand: 1-2010): European Union Concerted Action on Lyme
Borreliosis / EUCALB.com, New Jornal Ticks and Tick-borne
Diseases,
http://meduni09.edis.at/eucalb/cms/index.php?option=com_frontpage&Itemid=1
|
|
|
|
|
|
[220]
- http://www.vaskulitis.org/
|
|
|
|
|
|
[221]
- Klein, M., Pfister, H.-W. (2010): Leitthema - Bakterielle
Infektionen des Zentralnervensystems, Neurologische Klinik und
Poliklinik, Klinikum Großhadern, Universität München,
München, Nervenarzt 2010, DOI 10.0007/s0015-009-2854-6, ISSN
0028-2804 (Print) 1433-0407 (Online), Springer Verlag Berlien /
Heidelberg, 19. Januar 2010
|
|
|
|
|
|
[222]
- Margos, G., Vollmer, SA., Cornet, M., Fingerle V, Wilske,
B., Bornemane, A., Vitorino, L., Collares-Pereia, M., Drancurt,
M., Kurtenbach, K. (2009): A new Borrelia species defined ba
multilocus sequenc analysis of housekeeping genes, Department of
Biology and Biochemistry, University of Bath, 3 South, Claverton
Down, Bath BA2 7AY, United Kingdeom.gem250@bath.ac.uk, Appl
Environ Microbiol. 2009 Aug; 75(16):5410-6. Epub 2009 Jun 19.,
NCBI PubMed.gov U.S. National Library of Medicine National
Institut of Haelth, PMID: 19542332 [PubMed – indexed for
MEDLINE], PMCID: PMC2725479 [Available on 2010/2/1],
http://www.ncbi.nlm.nih.gov/pubmed/19542332
|
|
|
|
|
|
[223]
- Wang, G., van Dam, A.P., Schwartz, I., Dankert, J.
(1999): Molecular typing of Borrelia burgdorferi sensu lato:
taxonomic, epidemiological, and clinical implications., Clin
Microbiol Rev. 1999 Oct;12(4):633-53, Department of Medical
Microbiology, Acvademic Medical Centre, University of Amsterdam,
1105 AZ Amsterdam, The Netherlands, g.wang@amc.uva.ni, NCBI
PubMed.gov U.S. National Library of Medicine National Institut of
Haelth, PMID: 10515907 [PubMed – indexed for MEDLINE], PMCID:
PMC88929
|
|
|
|
|
|
[224]
- Blanc., F (2007): Neurologic and psychiatric
manifestations of Lyme disease, Département de neuologie,
hopitaux universitaires de Strasbourg, 1, place de I´Hopital,
67091 Strasbourg, France, frederic.blanc@chru-strasbourg.fr, Med
Mal Infect. 2007 jul-Aug;37(7-8):435-45. Epub 2007 Nar. 9.
(Article in French), NCBI PubMed.gov U.S. National Library of
Medicine National Institut of Haelth, PMID: 17350199 [PubMed –
indexed for MEDLINE],
|
|
|
|
|
|
[225]
- Chu, Ch.-Y., Liu, W., Jiang, B.-G., Wang, D.-M., Jaing,
W., Zhao, Q.-M., Zhang, P.-H., Wang, X., Peng, G.-T., Yang, H.,
Cao, W.-Ch. (2008): Novel Genospezies of Borrelia burgdorferi
Sensu Lato from Rodents and Ticks in Southwestern China, Received
June 24., 2008; Accepted July 6., 2008 J. Clin. Microbiol. 2008
Sep.; 46(9): 3130-3133., Published online 2008 July 9., doi:
10.1128/JCM.01195-08., PubMed Central – PMCID: PMC2546722
|
|
|
|
|
|
[226]
- Diza,E., Papa, A., Vezyri, E., Tsounis, St., Milonas, I.,
Antoniadis, A. (2004): Borrelia valaisiana in cerebrospinal fluid,
Aristotle University of Thessaloniki, Thessaloniki, Greece, The
Free Libray by Farlex, Health, Healt gerneral, Emerging Infections
Diseases, September 1., 2004,
http://www.thefreelibrary.com/Borrelia+valaisiana+in+cerebrospinal+fluid.-a0122552757
|
|
|
|
|
|
[227]
- Saito, K., Ito, T., Asashima, N., Ohno, M., Nagai, R.,
Fujita, H., Koizumi, N., Takano, A., Watanaba, H., Kawabata, H.
(2007): Borrelia valaisiana Infection in a Japanese Man
Association with Traveling to Foreign Countries, Case Report, The
Armerican Journal of Tropical Medicine and Hygiene – Am. J.
Trop. Med. Hyg., 77(6), 2007, pp. 1124-1127, The American Society
of Tropical Medicine and Hygiene,
http://www.ajtmh.org/cgi/content/full/77/6/1124
|
|
|
|
|
|
[228]
- Fraenkel, C.-J., Gaprmo, U., Berglund, J. (2002)
Determination of novel Borrelia genospecies in Swedish ricinus
ticks, American Society for Microbiology, Washington, DC,
ETATS-UNIS, Journal of clinical microbiologiy, ISSN 0095-1137,
Coden JCMIDW, 2002, Vol. 40, No. 9, pp. 3308-3312, CAT.INIST,
http://cat.inist.fr/?aModele=afficheN&cpsidt=13881008
|
|
|
|
|
|
[229]
- Rudenko, N., Golovchenko, M., Piskunova, N., Ruzek, D.,
Grubhoffer, L. (2008): Detection of Borrelia bissetii in the South
Bohemia region of Czech Republic: case of single and multiple
infections in humans, 18th European Congress of Clinical
Microbiology and Infections Diseases (ECCMID), 19.04.2008 –
22.04.2008, Home -22.04.2008 - Ticked off: Lyme borreliosis
|
|
|
|
|
|
[230]
- Susanne, K. (2008): Wirt-Vektor-Beziehungen und
genetische Hetrogenität von Borrelia burgdorferi sensu lato
in Borreliose Naturherden, Dissertation – zur Erlangung des
akademischen Grades Dr. rer. nat., Biologisch-Pharmazeutische
Fakultät der Friedrich-Schiller- Universität Jena,
08.07.2008
|
|
|
|
|
|
[231]
- Rösch, D. (2010): Glia macht Schule - Wiener Schüler
entwickelten ein Gerät , das den Gleichklang von Nervenzellen
im Gehirn messen kann. Inspiriert hat sie ein Artikel aus bild der
wissenschaft., Hirnforschung I, bild der wissenschaft, S. 30-31,
2/2010
|
|
|
|
|
|
[232]
- Wilhelm, K. (2010): Der neue Kontinent im Kopf –
Wenn wir nicht ganz bei der Sache sind, tritt in unserem Kopf das
neu entdeckte „Standard-Netzwerk“ in Aktion. Es hilft
uns, die Zukunft zu planen., Hirnforschung II, bild der
wissenschaft, S. 32-35, 2/2010
|
|
|
|
|
|
[233]
- Hildenbrand, P., Craven, D.E., Jones, R., Nemeskal, P.
(2009): Lyme Neuroborreliosis: Manifestations of a Rapidly
Emerging Zoonosis, American Journal of Neuroradiology, Published
ahead of print on April 3, 2009, doi: 10.3174/ajnr.A1579,
http://www.ajnr.org/cgi/content/full/30/6/1079
|
|
|
|
|
|
[234]
- Palecek, T., Kuchynka, P., Hulinska, D., Schramlova, J.,
Hrbackova, H., Vitkova, I., Simek, S., Horak, J., William, E.-L.,
Linhart, A. (2010): Presence of Borrelia burgdorferi in
endomyocardial biopsies in patients with new-onset unexplained
dilated cardiomyopathy, Biomedizin & Life Sciences, Medical
Microbiology and Immunology, Springer Verl. Berlin / Heidelberg,
Received: 17. Dez. 2009, Published online: 6. Jan. 2010, ISSN:
10.1007/s00430-009-0141-6, 5. Januar 2010,
http://www.springerlink.com/content/b8x4742136623114/
|
|
|
|
|
|
[235]
- Nau, R., Christen, H.-J., Eiffert, H. (2009):
Lyme-Borreliose – aktueller Kenntnisstand, Dtsch Arztebl.
Int. 2009; 106(5): 72-81, Archiv, Medizin: cme, DOI:
10.3238/arztebl. 2009.0072,
http://www.aerzteblatt.de/V4/archiv/artikel.asp?id=63176
|
|
|
|
|
|
[236]
- Lünemann, J.D., Gelderblom, H., Sospedra, M.,
Quandt, J.A., Pinilla, C., Marques, A., Martin, R. (2007):
Cerebrospinal Fluid-Infiltrating CD4+ T Cells Recognize Borrelia
burgdorferi Lysine-Enriched Protein Domains and Central Nervous
System Autoantigens in Erlay Lyme Encephalitis, American Society
fpr Microbiology, Infect and Immunity, January 2007, p. 243-251,
Vol. 75, No. 1, oo19-9567/07/$08.00+0, doi:10.1128/IAI.01110-06
|
|
|
|
|
|
[237]
- Kegel, B. (2009): Epigenetik – Wie Erfahrungen
vererbt werden, DuMont Buchverlag, Köln, 2. Aufl., ISBN
978-3-8321-9528-1
|
|
|
|
|
|
[238]
- UniPort (2010): Protein names: Chaperone protein htpG /
Gene names: htpG / BB0560, Reviewed, UniPortKB/Swiss-Port P42555
(HTPG_BORBU),Last modified January 19, 2010, Version 68,
http://www.uniprot.org/uniprot/P42555
|
|
|
|
|
|
[239]
- Raska, M, Weigl, E. (2005): Haet shock proteins in
autoimmune diseases, Biomed Pap Med Fac Univ Palacky Olomouc Czech
Repub., 149(2):243-9,
http://biomed.papers.upol.cz/pdfs/bio/2005/02/09.pdf
|
|
|
|
|
|
[240]
- Sacher, T. (2000): Die Rolle von Entzündungsreaktionen
bei Immunreaktionen gegen gesundes und malignes Gewebe:
Etablierung eines autochthonen Tumormodels, Inaugural –
Dissertation zur Erlangung der Doktorwürde,
Naturwissenschaftlichen – Mathematischen Gesamtfakultät
der Ruprecht-Karls-Universität Heidelberg,
http://deposit.ddb.de/cgi-bin/dokserv?idn=961831391&dok_var=d1&dok_ext=pdf&filename=961831391.pdf
|
|
|
|
|
|
[241]
- Heimerl, Ch. (2004 ): Untersuchungen zur Interaktion von
B. burgdorferi sensu lato mit Wirtszellen, Dissertation zur
Erlangung des Doktorgrades der Naturwissenschaften an der Fakultät
für Biologie der Ludwig-Maximilians-Universität München
|
|
|
|
|
|
[242]
- Harvey, W.T., Salvato, P. (2003): „Lyme disease“:
ancient engine of an unrecognized borreliosis pandemic?, Medical
Hypotheses, Received 16 July 2002, Accepted 11 Nov. 2002,
Available online 16 April 2003, , 60 (5), 742-759,
http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6WN2-48CN879-9&_user=10&_cover
Date=05%2F31%2F2003&_alid=1237221793&_rdoc=3&_fmt=high&_orig=search&_cdi=6950&_sort=r&_
docanchor=&view=c&_ct=7&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=
fdc4ed09e6e22ef3ccac2d23b8bf6f29, Übersetzt:
Jürschick-Busbach, B. Hartmann, F. (2009), „Lyme-Borreliose“
– uralter Motor einer unerkannten Borreliose-Pandemie?,
http://www.google.de/search?q=B.+J%C3%BCrschik
-Busbach&ie=utf-8&oe=utf-8&aq=t&rls=org.mozilla:de:official&client=firefox-a
|
|
|
|
|
|
[243]
- Sahay, B., Patsey, R. L., Eggers, Ch. H., Salazar, J. C.,
Radolf, J. D., Sellati, T.J. (2009): CD14 Signaling Restrains
Chronic Inflammation through Induction of p38-MAPK/SOCS-Dependent
Tolerance, PLOS Pathogens – a pper-reviewed open-acccess
journal published by the Public Library of Science, Published:
December 2009 / Issue of PloS Pathogens,
http://www.plospathogens.org/article/info:doi%2F10.1371%2Fjournal.ppat.1000687
|
|
|
|
|
|
[244]
- Olson, Ch. M., Bates, T. C., Izadi, H., Radolf, J. D.,
Huber, S. A., Boyson, J. E., Angnita, J. (2009): Local produktion
of IFN-gamma by invariant NKT cells modulates acute Lyme carditis,
The Journal of Immunology, 182: 3728-3734, Published Online: March
15, 2009, http://dx.doi.org/10.4049/jimmunol.0804111
|
|
|
|
|
|
[245]
- aerzteblatt.de (2007): Ursache
der AIDS-Demenz geklär – Viren schalten Stammzellen aus,
Deutsches Ärzteblatt: Nachrichten, Medizin, 2010
Deutsches Ärzteblatt, 16.
Aug. 2007, http://www.aerzteblatt.de/v4/news/news.asp?id=29513
|
|
|
|
|
|
[246]
-
Ramer, R., Merkord, J., Rohde, H., Hinz, B. (2010): Cannabidiol
inhibits cancer cell invasion via upregulation of tissue inhibitor
of matrix metalloproteinases-1., Institute of Toxicology and
Pharmacology, University of Rostock, Schillingallee 70, D-18057
Rostock, Germany, Biochem. Pharamacol. 2010 Apr 1;79(7):955-66.
Epub 2009 Nov 13, PubMed
– U.S. National Library Medicine National Institutes of
Health, PMID:
19914218 [PubMed - indexed for MEDLINE],
http://www.ncbi.nlm.nih.gov/pubmed/19914218
|
|
|
|
|
|
[247]
- Baden-Württemberg Stiftung (2010):
Baden-Württemberg Stiftung stellt
neueste Erkenntnisse aus der Borreliose-Forschung vor,
21.05.2010,Pressemitteilungen,
News & Presse, Baden-Württemberg
Stiftung – Wir stiften Zukunft,
http://www.bwstiftung.de/news-presse/pressemitteilungen/pressemitteilungen-detail/article/405.html,
Flyer: Prävention Lyme_Borreliose. Einfache Möglichkeiten
für effektiven Schutz, 10 Jahre Vorsprung für
Baden-Württemberg, Baden-Württemberg
Stiftung – Wir stiften Zukunft, Baden-Württemberg
Stiftung gGmbH, Im Kaisemer 1, 70191 Stuttgart,
info@bwstiftung.de, www.bwstiftung.de,
http://www.bwstiftung.de/fileadmin/Publikationen/Flyer_und_Broschueren/Lyme-Borreliose_Flyer_070510.pdf
|
|
|
|
|
|
[248]
- Kräft, G., Schubert, U. (2010): Streihkonzert und höhere
Gebühren auf breiter Front , Tageblatt Spezial, Göttinger
Tageblatt, S. 12-13, Mi., 26.05.2010
|
|
|
|
|
|
[249]
- Eisendle, K. (2010): Neue Aspekte kutaner Borreliosen
Immunhistochemie und Focus Floating Microscopy bei kutaner
Borreliose, Vortrag von PD Dr. Dr. Klaus Eisendle / Universität
für Dermatologie und Venerologie - Innsbruck,
Jahresversammlung der Deutschen Borreliose-Gesellschaft e.V. 2010,
Bad Herrenalb
|
|
|
|
|
|
[250]
- Eisendle, K. (2010): Neue Aspekte kutaner Borreliosen
Immunhistochemie und Focus Floating Microscopy bei kutaner
Borreliose, Vortragszusammenfassung von PD Dr. Dr. Klaus Eisendle
/ Universität für Dermatologie und Venerologie -
Innsbruck, Programm zur Jahresversammlung -Bad Herrenalb 28.-30.
Mai 2010, S. 11-12, Deutschen Borreliose-Gesellschaft e.V. 2010,
Bad Herrenalb
|
|
|
|
|
|
[251]
- Fisher J.B., Curtis C.E. (2010): An unexpected case of Lyme
disease in a soldier serving in northern Iraq, Military Medicine,
Volume 175, Number 5, May 2010 , pp. 367-369(3),
http://www.ncbi.nlm.nih.gov/pubmed/20486511
|
|
|
|
|
|
[252]
- Talhari,
S; Santos, MN; Talhari, CC; Ferreira, LC; Jr, RM; Zelger, B;
Massone, C; Ribeiro-Rodrigues, R., (2010): Borrelia Burgdorferi
"sensu lato" in Brazil: Occurrence confirmed by
immunohistochemistry and focus floating microscopy.,
Acta Trop. 2010; 115(3):200-204, Publikationen,
Forschungsportal, Medizinischen Universität Graz (PubMed:
http://www.ncbi.nlm.nih.gov/pubmed/20211144?dopt=Abstract)
|
|
|
|
|
|
[253]
- Bigi, S., Aebi, C., Nauer, C., Bigler, S., Steinlin, M. (2010):
Acute transverse myelitis in Lyme neuroborreliosis, Infection,
online before print, May 27, 2010,
http://www.springerlink.com/content/e44520883374r21k/
|
|
|
|
|
|
[254]
- Myers, T.A., Kausal, D., Philipp, M.T. (2009): Microglia Are
Mediators of Borrelia burgdorferi–Induced Apoptosis in
SH-SY5Y Neuronal Cells, Division of Bacteriology &
Parasitology, Tulane National Primate Research Center, Tulane
University Health Sciences Center, Louisiana, United States of
America, Funding: This work was supported by grants NS048952 and
RR00164 from the National Institutes of Health, The funders had no
role in study design, data collection and analysis, decision to
publish, or preparation of the manuscript, Competing interests:
The authors have declared that no competing interests exist,
Copyright: © 2009 Myers et al. This is an open-access article
distributed under the terms of the Creative Commons Attribution
License, which permits unrestricted use, distribution, and
reproduction in any medium, provided the original author and
source are credited, Received: May 11, 2009; Accepted: October 19,
2009; Published: November 13,, PLoS Pathog 5(11): e1000659.
doi:10.1371/journal. ppat. 1000659,
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2771360/
|
|
|
|
|
|
[255]
- Rademacher, R. (2010): Verwandlungskünstler im Darmtrakt -
Zwei Genmutationen schützen
Salmonellen vor der Zellabwehr, News, Biologie,
dpd/wissenschaft.de, 31.07.2010, bild der wissenaschaft, [Ferric
Fang (University of Washington, Seattle) et al.: Molecular Cell,
http://www.cell.com/molecular-cell/home,doi:
10.1016/j.molcel.2010.06.021],
http://www.wissenschaft.de/wissenschaft/news/311673
|
|
|
|
|
|
[256]
- umg (2011): Selbstschutz vor Krebs entdeckt –
regulationsmechanismus korrigiert menschliches Erbgut,
Wissenschaft & Weiter, Göttinger Tageblatt, Sonnabend,
19. Februar 2011, S. 32
|
|
|
|
|
|
[257]
- Seifert, H. (2011): Des Trippers Tauschgeschäft - Der
Erreger der Gonorrhoe hat offenbar Erbmaterial vom Menschen
übernommen, 15.02.2011 – Medizin, Hank Seifert
(Northwestern University, Chicago) et al: mBio,
Online-Veröffentlichung vom 14. Februar,
http://www.wissenschaft.de/wissenschaft/news/312974
|
|
|
|
|
|
[258]
- Casjens, S.R., Fraser-Liggett, C.M., Mongodin, E.F., Qiu, W.-G.,
Dunn, J.J., Luft, B.J., Schutzer, S.E., (2011): Genome
Announcement – Whole Genome sequence of an Unusual Borrelia
burgdorferi sensu lato Isolate, Journal of Bacteriology, March
2011, p. 1489-1490, Vol. 193, No. 6, 0021-9193/11/$12.00+0,
doi:10.1128/JB.01521-10, Copyright © 2011, American Society
for Microbiology. All Rights Reserved.
http://jb.asm.org/cgi/content/full/193/6/1489?view=long&pmid=2121700
|
|
|
|
|
|
[259]
- Krause, D. (2011): Infektion und psychische Störungen am
Beispiel von Tic-Erkrankungen, LMU / Klinikum der Universität
München, 8. Jahrestagung – Schwerpunkt: neurologische
und psychische Manifestationen, Vortrag, 09.04.2011, DBG /
Deutsche Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Wuppertal, 08.-10. April 2011
|
|
|
|
|
|
[260]
- Bransfield, R. (2011): The Psychoimmunology
of Tick Borne Diseases & its Association with Neuropsychiatric
Symptoms,
8. Jahrestagung - Schwerpunkt: neurologische und psychische
Manifestationen, Kliniken für Psychiatrie und Psychotherapie
II Universität Ulm, Vortrag, 09.04.2011, DBG / Deutsche
Borreliose-Gesellschaft e.V. - vereinigt Wissenschaftler und
Ärzte, die sich mit der Borreliose und assoziierten
Infektionskrankheiten befassen, Jahresversammlung, Wuppertal,
08.-10. April 2011
|
|
|
|
|
|
[261]
- Smith, RP Jr., Muzaffar, SB., Lavers, J., Lacombe, EH., Cahill,
BK., Lubelczyk, CB., Kinsler, A., Mathers, AJ., Rand, PW. (2006):
Borrelia garinii in seabird ticks (Ixodes uriae), Atlantic Coast,
North America, Maine Medical Center Research Institute, South
Portland, Maine 04106, USA, Emerg Infect Dis. 2006 Dez., 12 (12):
1909-12, http://www.ncbi.nlm.nih.gov/pubmed/17326943
|
|
|
|
|
|
[262]
- Staszewski, V., McCoy, KD., Bouliner, T. (2008): Variable
exposure and immunological response to Lyme disease Borrelia among
North Atlantic seabird species,Centre of Excellence in Evolution
Research, University of Jyväskylä, 40014 Jyväskylä,
Finland, C.E.F.E.-CNRS, UMR 5175, 34293 Montpellier, France,
Proceedings of the Royal Society, Biological Sciences, Royal
Society Publishing, doi: 10.1098/rspb.2008.0515, Proc. R. Soc. B.
22, September 2008 vol., 275no. 1647 2101-2109,
|
|
|
|
|
|
[263]
- Gylfe, A., Olsen, B., Stasevicius, Ras,
MM., Weihe, P., Noppa, L., Stberg, YO., Baranton, G., and D.,
Bergström, S. (1999): Isolation of Lyme disease Borrelia from
Puffins (Fratercula arctica) and Seabird ticks (Ixodes uriae) on
the Faeroe Islands, Departement of Microbiology and Infectious
Diseases, Umeä University, S-901 87 Umeä, Sweden, Unité
de Bactériologie Molécilare et Médical,
Institut Pasteur, Paris, France, Depertment of Occupational and
Public Health, The Faerose Hospital System, FR 100 Tórshavn,
The Faeroe Islands, Received 7 Aug. 1998, Returned for
modification 22 Oct. 1998, Accepted 21 Dec., American Society for
Microbiology, Journal of clinical Microbiology,
0095-1137/99/S04.0010, Apr. 1999, p. 890-896 Vol. 37, No. 4
|
|
|
|
|
|
[264]
- Olsén, B., Jaenson, TGT., Noppa, L., Bunikis, J.,
Bergström, S., (1993): A Lyme borreliosis cycle in seabirds
and Ixodes uriae ticks, Departement of Microbiology, and t
Department of Infectious Diseases, University of Umeä,
S-90187 Umeä, Sweden, Departemnt of Zoology, University of
Uppsala, Box 561, S-75122 Uppsala, Sweden, laters to nature -
Nature 362, 340-342 (25 March 1993), doi: 10.1038/362340a0,
http://www.nature.com/nature/journal/v362/n6418/abs/362340a0.html
|
|
|
|
|
|
[265]
- Comstedt, P. (2008): Biology of Borrelia garinii Spirochetes,
University dissertation from Umeä Universitet,
Molekylärbiologi - Medicinska fakulteten,
http://www.dissertations.se/dissertation/71cObbefe8/
|
|
|
|
|
|
[266]
- Burkot, TR., Mullen, GR., Anderson, R., Schneider, S., Happ,
ChM., Zeidner, NS. (2001): Borrelia lonestari DNA in Adult
Amblyomma americanum Ticks, Alabama - Statistical Data Included,
Health, Emerging Infections Diseases, May 2001,
http://findarticles.com/p/articles/mi mOGVK/is 3 7/ai 75996433/
|
|
|
|
|
|
[267]
- Margos, G., Vollmer, SA., Ogden, NH., Fish, D. (2011):
Population genetics, taxonomy, phylogeny and evolution of Borrelia
burgdorferi sensu lato,Department of
Biology and Biochemistry, University of Bath, Claverton Down, Bath
BA2 7AY, UK,
Zoonoses Division, Centre for
Food-borne, Environmental and Zoonotic Infectious Diseases, Public
Health Agency of Canada, Ottawa, Canada,
Yale School of Public Health, New
Haven, CT 06520, United States,
Elsevier, Infection, Genetics and Evolution, MEEDDID 1076, 12
August 2011, No. Of Pages 19, Model 5G, Infection, Genetics and
Evolution xxx(2011xxx-xxx, Article in press, Article history:
Received 12 May 2011, Received in revised from 29 July 2011,
Accepted 31 July 2011, Available online xxxx, 2011 Published by
Elsevier B.V.
|
|
|
|
|
|
[268]
- Lengauer, H. (2004): Untersuchung zum Zeckenbefall und zur
Prävalenz von Borrelia burgdorferi sowie Babesia divergens
beim Rind im Bayrischen Voralpenland, lnaugural-Dissertation, Aus
dem Institut für Vergleichende Tropenmedizin und
Parasitologie der Tierärztlichen Fakultät der
Ludwig-Maximilians-Universität München,
http://edoc.ub.uni-muenchen.de/2457/1/Lengauer_Heidi.pdf
|
|
|
|
|
|
[269]
- Dau, M. (2006): Interaktion genetischer Faktoren und
systemischer Entzündung als Risikofaktoren für
Parodontitis in der „Study of Health in Pomerania“
(SHIP-0), Dissertation - Publikation 30.05.2006, Medizinische
Falkultät, Institut für Pharmakologie, URN:
urn:nbn:de:gbv:9-000066-7 , URL:
http://ub-eb.ub.uni-greifswald.de/opus/volltext/2006/66/
|
|
|
|
|
|
[270]
- UniPort (2011): Chaperone protein htpG / Heat shock protein
htpG, High temperature protein G / Gene Locus BB_0560 - Borrelia
burgdorferi (Lyme disease spirochete), p42555 (HTPG_BORBU)
Reviewed, UniPortKB/Swiss-Prot, Last modified November 16, 2011,
Version 80, http://uniprot.org/uniprot/P42555
|
|
|
|
|
|
[271]
- Superfamily (2011): heat shock protein 90 (Borrelia garinii
Pbi), Genomes garinii Pbi - ref. YP_072999.1, gi. 51598811, home:
http://supfam.cs.bris.ac.uk/SUPERFANILY/cgi-bin/gene.cgi?genome=ga&seqid=gi
| 51598811
| ref|
YP_072999.1 (Stand: 04.05.2011)
|
|
|
|
|
|
[272]
- Lünemann, J.D., Gelderblom, H., Sospedra, M., Quandt, J.A.,
Pinilla, C., Marques, A., Martin, R. (2007): Cerebrospinal
fluid-infiltrating CD4+ T cells recognize Borrelia burgdorferi
lysine-enriched protein domains and central nervous system
autoantigens in early lyme encephalitis., Infect Immun. 2007 Jan;
75 (1): 243-51, Epub 2006 Oct 23., PMID: 17060473 [PubMed -
indexed for MEDLINE], PMCID: PMC1828376
|
|
|
|
|
|
[273]
- Taipale, M., Daniel, F., Lindquist, J and S. (2010): HSP90 at
the hub of protein homeostasis: emerging mechanistic, nature
Reviews molecular Cell Biology |
AOP, published online 9 June 2010; doi:
10:1038/nrm2818,
http://web.wi.mit.edu/linquist/pub/PDFs/Taipale2010NRMCB.pdf
|
|
|
|
|
|
[274]
- Lexic.us (2012): Definition of Borrelia burgdorferi, Borrelia
burgdorferi Pictures, Literary usage of Borrelia burgdorferi,
Nearby Words, More Information,
http://www.lexi.us/definition-of/borrelia_burgdorferi
|
|
|
|
|
|
[275]
- Mayne, P.J. (2011): Emerging incidence of Lyme borreliosis,
babesiosis, bartonellosis, and granulocytic ehrlichiosis in
Australia, International Lyme and Associated Diseases Society,
Bethesda, MD., USA, Open Access, Dovepress - open
access to scientific and medial research - case
sries, International Journal of General Medicine, 15 December 2011
|
|
|
|
|
|
[276]
- Dykhuizen, D., Brisso, D. (2010): Evolutionary Genetics of
Borrelia burgdorferi senso lato, Molecuar Biology, Host
interaction and Pathogenesis, Edited by: D. Scott Samuels, Justin
D. Radolf, Caister Academie Press, 2010, ISBN: 978-1-904455-58-5
|
|
|
|
|
|
[277]
- Chao, L-L., Wu, W.-J., Shih, C.-M. (2009): First Detechtion and
Molecular Identification of Borrelia burgdorferi-like Spirochetes
in Ixodes granulatus Ticks Collected on Kimmen Island of Taiwan,
Reprint requests: Chien-Ming Shih, Depertment of Parasitology and
Tropical Medicine, National Defense Medical Center, Taipei,
Taiwan, Republic of China, Received August 28, 2008, Accepted
December 3, 2008, Copyright 2009 The American Society of Tropical
Medicine, http://www.ajtmh.org/content/80/3/389.full
|
|
|
|
|
|
[278]
- Yang, X., Lenhart, T.R., Kariu, T., Anguita, J., Akins, D.R.,
Pall, U. (2010): Characterization of Unique Regions of Borrelia
burgdorferi Surface-Located Membran Protein 1, Infect Immun., 2010
November; 78 (11) : 4477-4487, Published online 2010 August 9,
Copyright 2009 The American Society for Microbiology, doi:
10.1128/IaI.00501-10, PMCID: PMC2976337,
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2976337/
|
|
|
|
|
|
[279]
- Hossain, H., Wellensiek, H.J., Geyer, R., Lochnit, G. (2001):
Structural analysis of glycolipids from Borrelia burgdorferie,
Biochemie 83 (7) : 683-92 (2001), PMID 11522398,
http://pubget.com/Paper/11522398
|
|
|
|
|
|
[280]
- Dai, J., Narasimhan, S., Zhang, L., Liu, L., Wang, P. (2010):
Tick histamine release factor is critical for Ixodes scapularis
engorgement and transmission of the lyme disease agent, Depertment
of Internal Medicine, Yale University School of Medicine, New
Haven, CT, USA, PloS Pathog. 2010;6 (11) : e1001205 21124826,
http://lib.bioinfo.pl/meid:45390/pmid
|
|
|
|
|
|
[281]
- Ljostad, U., Mygland, A (2007): CSF B - lymphocyte
chemoattractant () in the early diagnosis of acute Lyme
neuroborreliose, J. Neurol. (2008) 255:732-737, DOI:
10.1007/s00415-008-0785-y, Received: 26 June 2007, Received in
revised form: 26 September 2007, Accepted: 17 October 2007,
Published online: 17 March 2008,
http://resorces.metapress.com/pdf-preview.axd?code=r717rm42446t832m&size=largest
|
|
|
|
|
|
[282]
- Rupprecht, T.A. (2008): Das Chemokin als Biomarker in der
Liquordiagnostik der frühen Neuroborreliose, Abstarct,
Neurologische Klinik der LMU München,
http://www.lab-d-e.de/fileadmin/user_upload/arztinfo/fortbildung/liquorsymposium/2008/Abstarct_Ruprecht.pdf
|
|
|
|
|
|
[283]
- DGLN (1997): Liquor-Symposium 1997 Leipzig, DGLN / Deutsche
Gesellschaft für Liquordiagnostik und klinische Neurochemie,
www.uke.uni-hamburg.de/extern/dgln/pdf/abstracts_97.pdf
|
|
|
|
|
|
[284]
- Jungblut, P., Diligimen, A., Sascha, T., Wittmann, B. (2001):
Agents and method for diagnosing Lyme borreliosis vaccine,
Assignee: WITA GMBH, Intern. Classes: G01N33/569; G01N33/569;
(IPC1-7): G01N33/569, Document: WIPO Patent Application
WO/2001/042790, Kind Code: A2, Application: PCT/EP2000/012454,
Date: June 14, 2001,
http://www.sumobrain.com/patents/wipo/Agents-method-diagnosing-lyme-disease/WO2001042790.html
|
|
|
|
|
|
[285]
- Peter, H.H.(2011): 3.24 Vaskulitiden bei Nachweis kältelabiler
Serum- und Plasmaeiweiße (Kryoglobuline, Kryofibrinogen), 3
Diagnostische Kriterien, Praxis & Klinik, Deutsche
Gesellschaft für Rheumatologie e.V. ,
http://dgrh.de/qualitaetsmanual2_24.html
|
|
|
|
|
|
[286]
- Uni Rostock (2008): Untersuchung zur antiinvasiven Wirkung von
Cannabinoiden und ausgewählten Chemotherapeutika - Rolle von
Matrix-Metalloproteinasen undihrer endogenen Inihibitoren,
www.zpt.mod.uni-rostock.de/zpt/tip/seiten/schwerpunkte.html
|
|
|
|
|
|
[287]
- Hufschmidt, A., Lücking, C.H., Rauer, S. (2009): Neurologie
compact - Für Klinik und Praxis, 5., aktualisierte und
erweiterte Auflage, Georg Thieme Verlag KG, Rüdigerstr. 14,
70469 Stuttgart, Deutschland, ISBN 978-3-13-117195-5
|
|
|
|
|
|
[288]
- Lussi, A. (1987): Toxikologie der Amlgame, Schweiz,
Monatsschreiben Zahnmedizin 97: 1271-1279
|
|
|
|
|
|
[289]
- Embers, M.E., Bartold, S.W., Borda, J.T., Bowers, L., Doyla, L.,
Hodzic, E., Jacobs, M.B., Hasenkampf, N.R., Martin, D.S.,
Narasimhan, S., Phillippi-Falkenstein, K., Purcell, J.E.,
Ratterree, M.S., Philipp, M.T. (2012): Persistence of Borrelia
burgdorferi in Rhesus Macaques following Antibiotic Treatment of
Disseminated Infection, PloS ONE 7(1): e29914. Doi:
10.1371/journal.pone.0029914, Editor: Jean Louis Herrmann, Hopital
Raymond Poincare - Universite Versilles St. Quentine, France,
Recived July 22, 2011; Accepted December 6, 2011; Published
January 11, 2012, Open-Acces Freely availbale online,
www.plosone.org
|
|
|
|
|
|
[290]
- Koppensteiner, H., Banning, C., Schneider, C., Hohenberg, H.,
Schindler, M. (2011): Machrophagen internal HIV-1 is protected
from neutralizing antibodies, American Society for Microbiology,
Journal of Virology, First published December 2011, Doi:
10.1128/JVI.05915-11,
http://jvi.asm.org/Content/aerly/2011/12/21/JVI.05915-11.abstract
|
|
|
|
|
|
[291]
- Eggers, Ch. H., Kimmel, B. J., Bono, J. L., Elias, A. F., Rosa,
P., Samuels, D. S. (2001): Transduction by phiBB-1, a
bacteriophage of Borrelia burgdorferi, American Society for
Microbiology, Journal of Bacteriology, 2001 August; 183(16):
4771-4778, UK Pubmed central, Received February 16, 2001, Accepted
May 16, 2001, doi: 10.1128/JB.183.16.4771-4778.2001, PMCID:
PMC99531, ukpmc.ac.uk/articles/PMC99531//reload=0
|
|
|
|
|
|
[292]
- Alitalo, A., Meri, T., Cheng, T., Lankinen, H., Cheng, Z. Z.,
Jokiranta, T. S., Seppälä, I. J. T., Lahdenne, P.,
Hefty, p. S., Aksins, D. R., Meri, S. (2008): Lysine-Dependent
Multipoint Binding of the Borrelia burgdorferi Virulence Factor
Outer Surface Protein E to the C Terminus of Factor H, Department
of Bacteriology and Immunology, Haartman Institute and Helsinki
University Central Hospital, and Peptide and Protein Laboratory,
Haartman Institute, University of Helsinki, Heksinki Finland: and
Departement of Microbiology and Immunology, University of Oklahoma
Health Sciences Center, Okl, 9MED, 2008.06.26 / 22:57:15 Thursday,
journal.9med.net/qikan/article.php?id=391708
|
|
|
|
|
|
[293]
- Krstic, D., Madhusudan, A., Doehner, D., Vogel, V., Notter, T.,
Imhof, C., Manalastas, A., Hilfiker, M., Pfister, S., Schwerdel,
C., Riether, C., Meyer, U., Knuesel, I. (2012): Syystemic immune
challenges trigger and drive Alzheimer-like neuropathology in
mice, Journal of Neuroinflammation, 2. July
|
|
|
|
|
|
[294]
- Tatnom, S. (2012): Studie:
Alzheimer-Eiweiß lindert Symptome von Multiple Sklerose,
Health News, 02.08.12
|
|
|
|
|
|
[295]
-Locatelli, g., Wörtge, S., Buch, T., Ingold, B., Frommer,
F., Sobottka, B., Krueger, M., Karram, K., Bühlmann, C.,
Bechmann, I., Heppner, F. L., Waisman, A., Becher, B. (2012):
Primary oloigodendrocyte death does not elicit anti-CNS immunity,
Nature Neuroscience, 26.02.12, Doi: 10.1038/nn.3062
|
|
|
|
|
|
[296]
- Fugger, L. (2012): Gene link to multiple sclerosis explains drug
side effect, University of Oxford media news,
http://www.ox.ac.uk/media/news_releases_for_Journalisten/120709.html
|
|
|
|
|
|
[297]
- EF (2012) Zu viel Zellstress schwächt den Muskel –
Göttinger gewinen neue Erkenntnisse zur Krakheitsentstehung
chronischer Muskelentzündung, Wissenschaft & Wetter,
Göttinger Tageblatt, S. 18, 30.10.12
|
|
|
|
|
|
[298]
- dapd/cl (2012): Alzheimer wird beim Zellkontakt übertragen,
Neurologie, WeltOnline, 17:28, 28.06.12,
www.welt.de/gesundheit/article107289808/Alzheimer-wird-beim-Zellkontakt-uebertragen.html
|
|
|
|
|
|
[299]
- Wressnigg,
N., Pöllabauer, E.-V., Aichinger, G., Portsmouth, D.,
Löw-Baselli, A., Fritsch, S., Livey, I., Crowe, B. A.,
Schwendinger, M., Brühl, P., Pilz, A., Dvorak, T., Singer,
J., Firth, C., Luft., B., Schmitt, B., Zeitlinger, M., Müller,
M., Kollaritsch, H., Paulke-Korinek, M., Esen, M., Kremsner, P.
G., Ehrlich, H. J., Barrett, P. N. (2013): Safety and
immunogenicity of a novel multivalent OspA vaccine against Lyme
borreliosis in healthy adults: a double-blind, randomised,
dose-escalation phase 1/2 trial The Lancet Infectious Diseases,
Early Online Publication, 10 May 2013
doi:10.1016/S1473-3099(13)70110-5
|
|
|
|
|
|
[300]
- Hassler, D. (2013):
Das Langzeitprojekt “
Borreliose“ in Kraichtal –
Erkenntnisse für den Altag, Vortrag von PD Dr. med. Dieter
Hassler, 14.04.20113, DBG / Deutsche Borreliose-Gesellschaft e.V.
- vereinigt Wissenschaftler und Ärzte, die sich
mit der Borreliose und assoziierten Infektionskrankheiten
befassen, Jahresversammlung, Hamburg 12.-14. April 2013
|
|
|
|
|
|
[301]
- Liebisch, G. (2013):
Biologie, Epidemiologie und Kontrolle der Lyme Borreliose, Vortrag
von Dr. Gabriele Liebisch, 12.04.20113, DBG / Deutsche
Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Hamburg 12.-14. April 2013
|
|
|
|
|
|
[303]
- Reiber, H. (2013):
Neuroborreliose: Liquordiagnostik und Qualittätskontrolle,
Vortrag von Prof. Dr. Hansotto Reiber, 13.04.20113, DBG / Deutsche
Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen,
Jahresversammlung, Hamburg 12.-14. April 2013
|
|
|
|
|
|
[304]
- Lindner,
S. (2013):
The formins FMNL1 and m Dia1 regulate
coiling phagocytosis of Borrelia burgdorferi by primary human
macrophages,
Vortrag und Diskussion von/mit Prof. Dr. rer. nat. Stefan Lindner,
14.04.20113, DBG / Deutsche Borreliose-Gesellschaft e.V. -
vereinigt Wissenschaftler und Ärzte, die sich
mit der Borreliose und assoziierten Infektionskrankheiten
befassen, Jahresversammlung, Hamburg 12.-14. April 2013
|
|
|
|
|
|
[305]
- Comstedt, P., Hanner, M., Schüler, W., Meinke, A.,
Lundberg, U. (2014): Design and Development of a Novel Vaccine for
Protection against Lyme Borreliosis, PLOS-one, Published: Nov. 19,
2014, DOI: 10.1371/journal.pone.0113294,
http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0113294
|
|
|
|
|
|
[306]
- lymeaware.free.fr / MedHunt
/ (2007): Maladies liees la morsure des tiques en
Fr., L'auteur du site a le soutien du Professeur Claude Chastel
(Correspondant National de l'Académie de Médecine),
Health On the Net Stiftung MedHunt, Dernière mise à
jour : le 13 11 2007,
http://lymeaware.free.fr/lyme/Websave/maladiesatiques/www.maladies-a-tiques.com/Argasides-et-pathologies_.htm
|
|
|
|
|
|
[307]
- Kraiczy, P. (2011): Wie sich Borrelien der Immunabwehr
entziehen, Institut für Medizinische Mikrobiologie und
Krankenhaushygiene, Klinikum der Johann Wolfgang
Goethe-Universität, Paul-Ehrlich-Str. 40, 60596
Frankfurt, Mikrobiologie 21.Jg. 2011, S. 186-192
|
|
|
|
|
|
[308]
- Schöler, A. (2003): Untersuchungen zur Biologie und
Ökologie der Herbstmilbe Neotrombicula autumnalis (Acari:
Trombiculidae) im Hinblick auf Bekämpfungsmöglichkeiten
sowie zu ihrer Bedeutung als Vektor der Borreliose, Dissertation
zur Erlangung des Doktorgrades (Dr. rer. nat.),
Mathematisch-Naturwissenschaftlichen Fakultät der Rheinischen
Friedrich-Wilhelms-Universität Bonn
|
|
|
|
|
|
[309]
- Criado, P.R., Criado, R.F.J. (2010): Ixodiasis disclosed by
epiluminescence microscopy without skin contact. An Bras Dermatol.
2010;85(3):388-9,
http://www.scielo.br/pdf/abd/v85n3/en_a17v85n3.pdf
|
|
|
|
|
|
[310]
- Stanek, G., Reiter, M., Stanek, G., Reiter, M. (2011): The
expanding Lyme Borrelia complex--clinical significance of genomic
species?, Clin Microbiol Infect. 2011 Apr;17(4):487-93. doi:
10.1111/j.1469-0691.2011.03492.x.,
http://www.ncbi.nlm.nih.gov/pubmed/21414082
|
|
|
|
|
|
[311]
- Back, T. (2014):
Neuroborreliosis-associated cerebral vasculitis: 11 cases from
East Saxony, 04.04.20114, DBG / Deutsche Borreliose-Gesellschaft
e.V. - vereinigt Wissenschaftler und Ärzte, die
sich mit der Borreliose und assoziierten Infektionskrankheiten
befassen, 11. Jahrestagung d. DBG e.V., Erfurt 04.-05.
April 2014
|
|
|
|
|
|
[312]
- Heinz, T. (2014):
Axonaler Schaden im Mäusegehirn nach intraventrikulärer
Infusion des OspC von Borrelia burgdorferi, 05.04.20114, DBG /
Deutsche Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen, 11.
Jahrestagung d. DBG e.V., Erfurt 04.-05. April 2014
|
|
|
|
|
|
[313]
- Perrone, Chr. (2014):
The gap between current diagnostic test for Lyme disease and
associated diseases and the diversity fpr pathogens isolated in
the world, 05.04.20114, DBG / Deutsche Borreliose-Gesellschaft
e.V. - vereinigt Wissenschaftler und Ärzte, die
sich mit der Borreliose und assoziierten Infektionskrankheiten
befassen, 11. Jahrestagung d. DBG e.V., Erfurt 04.-05.
April 2014
|
|
|
|
|
|
[314]
- Hübner, A. (2014):
Lyme-Neuroborreliose (LNB), 05.04.20114, DBG / Deutsche
Borreliose-Gesellschaft e.V. - vereinigt
Wissenschaftler und Ärzte, die sich mit der Borreliose und
assoziierten Infektionskrankheiten befassen, 11.
Jahrestagung d. DBG e.V., Erfurt 04.-05. April 2014
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Weitere
verwendete Quellen siehe Seite: >>Quellen / weiterführende
Literatur / Internet<<
|
|
|
|
|
|
|
|
|
|
|
|
[A]
= Hierdurch können die Borrelien gar nicht, oder nur mäßig
von der Immunabwehr erkannt und bekämpft werden. Weiter ist
z.B. eine Granulomatose ein guter Schutz für die Borrelien
vor Antibiotikum.
|
|
|
|
|
|
Punkt
[26a] macht bei einer chronischen
Manifestierung eine sogenannte gepluste Heidelberg-Therapie (bis
zu 10 Antibiotikum-Behandlungszyklen) durchaus sinnvoll. Sowie
eine komplementärmedizinische Begleittherapie [26b],
z.B. mittels Homöopathie und/oder mit Knoblauchtrockenextrakt
(Senkung des Fibrinogengehalts) sowie mit Einreiben der
geschwollen Gelenke/Hautbereich mit Rheumasalbe zur Weitung der
Mikro-Blutgefäße. Mit diesen Maßnahmen kann
eventuell eine bessere Antibiotikum-Erreichbarkeit der Borrelien
in den Mikro-Blutgefäßen bewirkt werden.
|
|
|
|
|
|
|
|
|
|
|
|
[B]
= latente Borrliose (schlafend) [46],
Infra NB (unfertig) [47],
Lyme-Borreliose-Syndrom [3] =
Patienten bei denen kein Nachweis gelingt, die aber auf eine
entsprechende Antibiotikum-Therapie ansprechen (Struktur-dominate
Prädisposition, Borrelien-Gen-Loci-Mimikry, unterbrochene
Immunkaskade durch falsche, zu schwache frühe
Antibiotikum-Therapie). Die Auswahl der
Patienten für diese Studien erfolgt meisten im wesentlichen
nach dem derzeit gültigen MiQ-Kriterien (Mikrobiologischer
infektiologischer Qualitätsstandard), bei denen
Fälle ohne EM nicht mit in die Statistik einfließen,
wenn die Serologie negativ ausfällt. Aus diesem Grund geben
diese Studien ein falsch positives Bild bezüglich der
serologischen Diagnosesicherheit wieder, da die Diagnostik anhand
der dort aufgeführten Zahlen (Sero-,
PCR- u. Direktnachweisdiagnostik) sicherer erscheint,
als sie tatsächlich ist. Vergleiche der Titerhöhen
können schon deshalb nicht erfolgen, da es unter den
Untersuchungslaboren keine einheitliche sogenannte
cut-off-Definition gibt. In einigen Studien spricht man z.B.
bei der Sero-Nachweisbarkeit bei NB-Fällen im Stadium 2 von
24 %, 49 %, 63 % Nachweisbarkeit, es klafft also eine
Spanne von 39 % Unsicherheit schon bei diesen Studien. So
wurden z.B. bei der Münchner Studie [62]
insgesamt 852 Patienten (1991-1993) einbezogen, die entweder
ein eindeutiges Borrelien EM zeigten oder aber eine positive
Borrelien-Serologie aufwiesen. Fragliche pathogene
Borreliose-Fälle (z.B. ohne EM) sind bei dieser Studie somit
auch außen vor! So schreibt G. Baumann in ihrer Dissertation
hierzu folgendes:
|
|
|
|
|
|
>>
Die Auswahl der Patienten erfolgte nach Auswertung
eines Fragebogens, der an alle Patienten mit positiver
Lyme-Borreliose-Serologie verschickt wurde. Zusätzlich
wurden Patienten mit klinisch typischem Befund für
Erythema migrans ohne serologischen Hinweis für
Lyme-Borreliose aufgenommen. Das Einzugsgebiet des
Max-von-Pettenkofer Institutes für Hygiene und Medizinische
Mikrobiologie der Universität München entspricht weiten
Teilen Süddeutschlandes und deckt ein breites klinisches
Spektrum ab. Zu den Einsendern zählen Krankenhäuser
der obersten Versorgungsstufe, somit waren schwere klinische
Manifestationen überrepräsentiert. <<......>>Die
Patienten wurden weitgehend nach positiven serologischen
Untersuchungsergebnissen ausgewählt und können somit die
Prävalenz der Erkrankung in der Gesamtbevölkerung nur
annäherungsweise widerspiegeln.<<......>>Eine
Vorselektion des Hauptteiles unserer Patienten durch
Serumreaktivität lässt keinen Rückschluss auf die
Häufigkeit der Serumantwort bei den einzelnen
Manifestationsformen zu. Entsprechende klinische Studien
zeigen einen beträchtlichen Anteil v.a. von Patienten mit
Frühmanifestationen ohne Serumreaktion. Asbrink et al.
(Asbrink et al., 1986b) geben bei Erythema migrans eine
Serokonversion bei 15-25% an. Stanek et al. (Stanek et al., 1986)
geben eine Seroreaktivität bei 22% der Patienten mit Erythema
migrans an.<< - soweit das Zitat
|
|
|
|
|
|
|
|
|
|
|
|
[C]
- Präzipitionsreaktion(en):
|
|
|
|
|
|
1.-
immunologisch sogen. Präzipitionshemmung: hierbei handelt es
sich um eine verminderte oder fehlende Bildung bzw. Auflösung
von sogen. Immunpräzipitats – d.h. um unlösliche,
quervernetzte kleine Immunkomplexe (IK). Im Labor (Immundiffusion
u./o. Elektrophorese) ist der IK-Niederschlag sichtbar durch
Trübung, er kann mittels Nephlometrie, Turbidimetrie bzw.
nach Zentrifugation durch Eiweißbestimmung bestätigt
werden, sofern das Untersuchungslabor eine eventuelle
Präziptionshemmung berücksichtigt. Der Nachweis von
Immunkomplexen gelingt z.B. mittels
Polyäthylenglykol-Präzipitation oder sogen.
C1q-(Komplement-)Bindungstests. Die Präzipitionshemmung gilt
als eine der häufigsten Ursachen für falsch negative
Befunde.
|
|
|
|
|
|
2.-
biochemisch sogen. Fällungsreaktion: Niederschlag beim
Überschreiten der Löslichkeitsgrenze. Durch eine
Veränderung des pH-Wertes, der Temperatur oder der
Konzentration der Reaktionspartner ist in der Regel eine getrennte
Ausfällung der Lösungsbestandteile möglich.
|
|
|
|
|
|
|
|
|
|
|
|
[D]
- Agglutination:
|
|
|
|
|
|
hierunter
versteht man in der Labormedizin eine Verklumpung von AG-tragenden
Teilchen (z.B. Bakterein, Erythrozyten), welche zum Nachweis von
Krankheitserregern genutzt wird.
|
|
|
|
|
|
Bei
Leptospiren [G]
als sogen. ALR-Test (Agglutinations-Lysis-Reaktion)
zum Nachweis in Verwendung. Hierbei werden dem verdünntem
Liquor oder Serum des Patienten flüssige Leptospira-Kulturen
zugesetzt. Wenn es zu Verklumpungen oder Auflösung der
Leptospiren kommt, gilt er als positiv.
|
|
|
|
|
|
Auch
der Nachweis von Treponema-pallidum-Antikörpern (= Erreger
der Syphlis) gelingt mittels
Spirochäten-Agglutinationsreaktions-Test. Bei diesem Test
wird die Patientenprobe (z.B: Liquor) mit Spirochäten-Antigenen
inkubiert und vermischt. Bleibt die Probe homogen trüb, gilt
das Ergebnis als negativ. Kommt es zur Ausflockung, gilt das
Ergebnis als positiv.
|
|
|
|
|
|
|
|
|
|
|
|
[E]
- stille Feiung:
|
|
|
|
|
|
hierunter
versteht man in der medizinischen und immunologischen Fachwelt
eine Immunisierung, die auf unbekannte Weise erfolgt. Man vermutet
aber, dass sie durch andauerenden oder aber mehr oder weniger
regelmäßigen unbemerkten Kontakt zu den entsprechenden
Krankheitskeimen (z.B. Borrelia) erlangt wird. Auf diese Weise
kommt es zu einer ständigen Auseinandersetzung zwischen
Immunsystem und dem Krankheitskeim, wodurch auch sich frei
bewegende persistirenden Erregern (z.B. Borrelien, die ihre Nische
verlassen haben) eliminiert werden, sie sich somit nicht weiter im
Körper ausbreiten und in neuen Nischen festsetzen können.
|
|
|
|
|
|
|
|
|
|
|
|
[F]
– Nosode:
|
|
|
|
|
|
aus
krankhaften Körperprodukten gewonnene und in höheren
Potenzen zur Behandlung der gleichen Erkrankung angewandte Arznei.
Wirkweise: vermutlich bleiben durch die orale Verabreichung die
Borrelien über einem längeren Zeitraum für das
Immunsystem erkennbar, wodurch sich für eine gewisse Zeit
dann eine Immunität >>stille Feiung [E]<<
ausbildet.
|
|
|
|
|
|
|
|
|
|
|
|
[G]
= Fam. II der Spirochaetales / Fam. I =
Borrelien u. Treponema. Da die Erkrankungen mit diesen Erregern
alle der Ordnung Spirochaetales (Borrelia, Leptospira u.
Treponema) angehören, spricht man bei ihnen insgesamt von
Spirochätose
|
|
|
|
|
|
|
|
|
|
|
|
[H]
= Hier setzt eventuell auch die Homöopathie
an. Nach der Lehre der Homöopathie behandelt man Ähnliches
mit Ähnlichem. Zweifler sagen zwar, dass die Substanz dank
der hohen Verdünnung (Potenzierung) nicht mehr vorhanden ist,
was ansich ja schon unlogisch ist, da eine Substanz nicht
verschwindet, wird sie auch noch so hoch verdünnt. Eventuell
liegt sogar gerade darin die Wirkung, dass nicht bei jeder Gabe
das entsprechende “Antigen“
vorhanden ist, sondern nur in sehr unregelmäßigen
Abständen. Auf diese Weise würde die Immunabwehr immer
wieder gewahr, dass der “Feind“ noch anwesend ist und
bekämpft werden muss. Wäre dagegen die Wirksubstanz
immer gleichbleibend vorhanden, würde die Immunabwehr sich
daran gewöhnen und eventuell der Effekt der “low
zone immunparalyse“ (siehe oben:
Tarnmechanismen der Borrelien) oder der AK-AG-Komplexbildung mit
seinen inzwischen bekannten krankmachenden Mechanismen einsetzen
(siehe Seite: Symptome). Da die Verdünnung (Potenzierung)
nicht durch Verrühren erreicht wird, sondern es in der
Lehre der Homöopathie wie folgt lautet: “Geschlagen und
nicht gerührt“! - könnte hier ein weiteres
Geheimnis verborgen sein. Beim normalen Verrühren würden
die Substanzen nur aneinander reiben und schleifen, so eventuell
sogar ihre ursprüngliche Oberflächenstruktur verlieren.
Beim homöopathischen Schlagen wird vielleicht den
Nachbarmolekülen die Oberfläche spiegelbildlich wie mit
einem Stempel durch die Wucht des Schlagens aufgeprägt, was
gar nicht mal immer perfekt geschehen muss und eventuell gerade
deshalb die Wirksamkeit erhöht. Auf diese Weise werden
vielleicht nicht nur die spezifischen-Peptide (Kontakt-Rezeptoren)
der Immunabwehr erreicht, sonder eventuell die ähnlichen-Peptide
der sogenannten “Bystander-Immunzellen“.
|
|
|
|
|
|
|
|
|
|
|
|
[I]
- Allerdings müssen verschiedene
Voraussetzungen für einen krankhaften Autoimmunverlauf
erfüllt werden: die Kreuzreaktion des Selbst- und
Krankheitskeimpeptids muss entsprechend hoch oder lange genug
vorhanden sein, die entsprechenden T-Zellen müssen an den Ort
gelangen, wo das entsprechende Selbsantigen vorkommt etc.
|
|
|
|
|
|
|
|
|
|
|
|
[K]
- Bei nachfolgenden entzündlichen/autoimmunen
Erkrankungen kommt es auch zu einen erhöhten IL-18 Spiegel
[57]: Rheumatoide Arthritis, Juvenile
chronischer Arthritis, Lupus erythematodes, Psoriasis, Morbus
Crohn, Akute Pankreatitis, Allergische Rhinitis, Type 1 Diabetes,
Arteriosklerose, Multiple Sklerose, Sarkoidosis, Nephrotisches
Syndrom, Chronische Herzinsuffizienz, Mystasthenia Gravis –
einige dieser Krankheiten können nach heutiger Kenntnis auch
als Skundärerkrankungen aus der “low-dose-borreliosis“
entstehen.
|
|
|
|
|
|
|
|
|
|
|
|
[L]
- Die zytolytischen Stoffe der Zecken können eine
Bedeutung bei der Borrelienübertragung haben. Es ist bekannt,
dass die Borrelien die Wände kleiner Kapillar-Blutgefäße
durchdringen und sich so im umliegenden kollagenen Verbundgewebe
vor der Immunabwehr verstecken. Das bevorzugte Rückzugsmedium
der Bb. sl.-Komplex Borrelien ist die Haut , da sie quasi die
Schnittstelle für Zecken darstellt. Durch die zytolytische
Auflösung der Kapillar-Gefäßwände tritt Blut
ins umgebende kollagene Verbundgewebe ein, wodurch es zur
Aktivierung bzw. Rückverwandlung ruhender zytischer Borrelien
(L-Form Borrelien) kommen kann, die dann in Richtung Zecke aus dem
Stapelwirt abwandern. Es ist inzwischen nachgewiesen, dass sich
L-Form-Borrelien innerhalb von 24 Stunden durch Kontakt zum Blut
zurück in voll bewegliche Borrelien verwandeln können
[67].
|
|
|
|
|
|
|
|
|
|
|
|
[M]
- Spekulativ, Autor (A. Hartwig): Es denkbar, dass es durch
Entzündungsprozesse, die eigentlich gegen die im Kollagen
versteckten Borrelien gerichtet sind, zur Lösung von
Kollagen-Fragmenten kommt, welche sich in Folge an andere,
eventuell weit entfernte Stellen als sogenannte Plaques an den
Innenwänden der Blutgefäße ablagern. Die Folge der
Ablagerungen wäre dann eine Verdickung der Gefäßwände
mit Versteifung und Verengung, also der Beginn einer
Arterienverkalkung, welche letztendlich zum Schlaganfall führen
kann (siehe auch [V]).
|
|
|
|
|
|
|
|
|
|
|
|
[N]
- Durch Borrelien beeinflusste
menschliche Gene [67]:
|
|
|
|
|
|
1.-
hochregulierte Gene 24 h nach Infektion durch lebende Borrelien:
ID-1 (DNA-binding protein inhibitor), DNA-Pk (DNA-dependent
protein kinase), CD4-antigen (T-cell surface glycoprotein), PRG-1
(IEX-IL anti-death-protein) und LPIC (Lysosomal
peptstatin-insensitive protease),
|
|
|
|
|
|
2.-
runterregulierte Gene 24 h nach Infektion durch lebende Borrelien:
ITGB 8 (Integrin beta 8 precursor), VEGFR 2 (Vascular endothelial
growth factor receptor 2 precursor) und TGF-beta 2 (Transforming
growth factor beta precursor)
|
|
|
|
|
|
3.-
komplex regulierte Gene durch lebende und tote Borrelien: ICAM-1
Gen (intercellular adhesion molecule-1 precursor) und MIP-2a
(Macrophage inflammatory protein 2 alpha)
|
|
|
|
|
|
|
|
|
|
|
|
[O]
- Leukozyten (= weiße
Blutkörperchen) sind Abwehrzellen (Immunzellen) und werden in
Granulozyten, Lymphozyten und Monozyten unterschieden. Die
Phagozyten (Fresszellen) beseitigen unbelebte und belebte
Fremdpartikel wie z.B. Mikroorganismen, Blutzellen, Gewebstrümmer
usw. Die Phagozyten werden unterschieden in mobile Mikrophagen
(Granulozyten) und überwiegend ortsgebundene (sessile)
Makrophagen (Histo-, Monozyten, Mikroglia, Sinuswand- u.
Retikulumzellen) - siehe auch Seite
"Immunorgane/Disposition/Kreuzreaktion". Granulozyten
werden in der Regel durch chemische Lockstoffe (sogen. Lymphokine,
Komplement usw.) oder aber auch direkt durch bakterielle Stoffe
zum Ort der Entzündung gelockt.
|
|
|
|
|
|
|
|
|
|
|
|
[P]
- Es wurden Vergleiche zu folgenden
Bakterien durchgeführt [67]:
|
|
|
|
|
|
1.-
gramnegative Bakterien: Escherichia coli, Salmonella
dublin und Bordetella pertussis
|
|
|
|
|
|
2.-
grampositive Bakterien: Listeria monocytogenes und Clamydia
trachomatis
|
|
|
|
|
|
Von
diesen Erregern werden nachfolgende als intrazellulär
eingestuft: Clamydia trachomatis, Salmonella dublin
und Listeria monocytogenes.
|
|
|
|
|
|
Borrelien
werden zu den gramnegativen Bakterien gezählt. Bakterien
unterscheidet man nach ihrem Färbverhalten in grampositiv (=
Carbolfuchsin- bzw. Safranin-rot) und gramnegativ (=
Karbol-Gentianaviolett, blau), dies spiegelt sich in der Regel
auch in der Empfindlichkeit gegen Antibiotika wieder. Grampositive
Bakterien, die durch Chemotherapeutika (z.B. durch Antibiotika)
geschädigt sind, können ein wechselhaftes Verhalten
(gramlabil) zeigen.
|
|
|
|
|
|
|
|
|
|
|
|
[Q]
- Integrine werden auch von anderen
gefährlichen Krankheitserregern missbraucht, sie werden von
diesen Erregern quasi als Zugangspforten zum Zielgewebe oder in
Zellen genutzt. Neben den Borrelien ist dieser Missbrauch von
Intigrinen für nachfolgend aufgeführte Erreger
nachgewiesen: Bordetella pertussis (Keuchhusten), Yersinia spp.
(z.B. Y. pestis, Erreger der Pest), Adenovirus
(Atmungsorganerkrankung - teilw. Tumorbildung anregend),
Coxackivirus (Sommergrippe - Meningitis, Myokarditis etc.) ,
Echovirus (Multisystemerkrankung), Hantavirus (hämorragisches
Fieber), HIV (Immunschwächeerkrankung - AIDS), Rotavirus
(Gastroenteritis - Hauptursache der Säuglingssterblichkeit),
Shigella spp. (Bakterienruhr) usw.
|
|
|
|
|
|
Neben
den Erregern werden die Integrine auch von Egeln, Zecken
(Plättchenaggregation) und Schlangengift (Disintegrine)
reguliert, so dass es zur Gerinnungshemmung oder Zersetzung von
Gewebe kommt.
|
|
|
|
|
|
Bei
der Krebsentstehung dem Wachstum und der Versorgung bösartiger
Krebszellen spielt eine Disregulation der Integrine auch eine
wichtige Rolle.
|
|
|
|
|
|
|
|
|
|
|
|
[R]
- Dies empfiehlt auch das Niedersächsische
Sozialministerium seit 1994 (Niedersächsisches
Sozialministerium / Postfach 141 / 30001 Hannover) in seinem
Ratgeber >>Vorsicht bei Zeckenstich<< oder die
Landesarbeitsgruppe Borreliose und FSME Baden-Württemberg
e.V. (c/o Landesgesundheitsamt, Wiederholdstraße 15, 70174
Stuttgart) in ihrem Merkblatt 2 >>Antibiotische Prophylaxe
nach Zeckenstich – ja oder nein?<<.
|
|
|
|
|
|
Vom
LfAS [79] wird eine Untersuchung von
angesogenen und entfernten Zecken allerdings nicht empfohlen, da
eine Fall-Studie anhand von 87 Zecken kein entsprechendes Ergebnis
erbracht haben soll. Von den 87 untersuchten Zecken waren 18
Borrelien-positiv, erkrankt sei aber keiner der Patienten an den
infektiösen Zecken. Gleichzeitig spricht das LfAS aber von
50.000 bis 80.000 Neuerkrankungen pro Jahr in Deutschland. Ob man
daher diese Studie an nur 87 bzw. 18 Fall-Beispielen (87 zu
50.000) als repräsentativ werten kann, mag jeder Arzt und
Patient für sich selbst entscheiden. Ich (Autor) kann
jedenfalls das Ergebnis dieser Studie des LfAS [79]
bezüglich der Zeckenuntersuchung nur als wenig ernst zu
nehmende Empfehlung auffassen (siehe auch Punkt [X]).
Dies wäre grad so, als wenn man Skippern empfehlen würde,
keine Schwimmwesten oder Rettungsringe (gzsm [a]
Zeckenutersuchung) mehr mit an Bord ihres Schiffes zu nehmen, weil
auch diese nicht 100 % sicher sind und defekt sein können
(gzsm Laborfehler; falsch neg. o. pos.). Außerdem kann es ja
vielen Schiffbrüchigen gelingen, auch ohne Schwimmweste ans
rettende Ufer zu gelangen (gzsm Spontanheilung der
Lyme-Erkrankung), bzw. sich so lange ohne größeren
Schaden über Wasser zu halten bis z.B. ein Seenotrettungsboot
sie findet und aufnimmt (gzsm serologischen
Bb.sl.-Komplex-AK-Nachweis). Eine weitere Begründung, keine
Schwimmwesten mit an Bord zu nehmen, könnte sein, dass ein
Schiffbrüchiger auch trotz Schwimmweste z.B. an Unterkühlung
sterben könnte (gzsm Ko-Infektion, z.B. Ehrlichose usw.).
Aber jeder vernünftig denkende Mensch wird wohl unbestritten
feststellen, dass eine Schwimmweste (gzsm Zeckenuntersuchung) in
der Regel trotz alledem ein gutes präventives Hilfsmittel
gegen Ertrinken (gzsm Borrelieninfektion) ist, insbesondere für
Nichtschwimmer (gzsm Patienten-Prädisposition z.B. durch den
Faktor HLA-DR2 etc.). Letztgenannte wären ohne dieses
sinnvolle Hilfsmittel Schwimmweste (gzsm Zeckenuntersuchung) wohl
in den meisten Fällen von vorneherein verloren, wenn sie
nicht rechtzeitig (gzsm dem frühen behandelbaren
Lyme-Stadium) vor dem Ertrinken (gzsm Autoimmunreaktion) durch die
Seenotrettung gefunden und aufgegriffen werden, was aber häufig
nicht gelingt (gzsm falsch neg. Bb.-Befund im Stadium 1 u. 2). Ist
aber das rettende Ufer weit weg und man treibt ohne Schwimmweste
(gzsm nicht durchgeführte Zeckenuntersuchung) auf hoher See
(gzsm kein EM o. keine Bb.-AK-Reaktion), kann einem nur noch eine
glückliche Schicksalsfügung helfen, nämlich ein
erreichbares Stück schwimmfähiges Treibgut (gzsm Arzt,
der sich zutraut, auch nur auf Grund von klinschen Symptomen zu
behandeln). Meine Meinung ist, dass ein jeder, der am Leben hängt
und sich in einer Notfallsituation befindet oder befand, wohl kein
Rettungs- bzw. präventives Hilfsmittel wie z.B. eine
Schwimmweste, Sicherheitsgurt, Schutzhelm (Motorrad, Bau usw.)
abweisen würde - dies würden nur Törichte tun.
|
|
|
|
|
|
[a]
- die Abkürzung >>gzsm<< steht für gleich zu
setzen mit
|
|
|
|
|
|
|
|
|
|
|
|
[S]
- Wie die Schizophrenie im einzelnen entsteht ist noch
unklar, es ist nur sicher, dass sowohl eine erbliche Veranlagung
als auch Umweltbedingungen an der Entstehung beteiligt sind. Unter
Umweltbedingungen muss man den Kontakt mit einem Auslösefaktor
(Trigger) verstehen, z.B. kann das Rauchen einer einzigen
Hasch-Zigarette (Cannabis) ausreichen um diese komplexe
psychiatrische Erkrankung auszulösen [81].
Es wäre aber auch denkbar, dass eine Infektion mit Borrelien
die Erkrankung auslöst - siehe Absatz Tarnstrategien CB-Gen
bzw. Cannabisrezeptor. Epidemiologische Daten sprechen jedenfalls
auch für einen möglichen Zusammenhang zwischen
Schizophrenie und Borreliose [20/21].
Die genetische Veranlagung ( siehe auch [45])
darf sicherlich nur als Prädisposition verstanden werden,
nicht als eigentliche Ursache. Das heißt, wenn man nur die
Veranlagung in sich trägt, aber nicht mit dem entsprechenden
Trigger (Cannabis, Borrelien etc.) in Kontakt kommt, bleibt man
gesund, kommt man aber mit dem Trigger in Kontakt, wird die
Erkrankung ausgelöst.
|
|
|
|
|
|
-
In Deutschland leiden ca. 800000 an Schizophrenie, ein Prozent der
Bevölkerung macht in ihrem Leben einen schizophrenen Schub
von Wochen bis Monaten Länge durch, bei ca. 80 % dieser Fälle
kommen diese Schübe oft ein ganzes Leben lang wieder [81].
Auslöser sind meist Unregelmäßigkeiten im Altag
wie traumatische Erlebnisse, Trauer, übermäßiger
Dis-Streß aber auch übermäßiger Eu-Streß,
alles Umstände, die indirekten Einfluss auf die Immunabwehr
haben, was z.B. auch zur schubweisen Borrelienaktivität
führen kann. Bei 20 % der Schizophrenen kommt es zur
Spontanheilung.
|
|
|
|
|
|
-
Schizophrenie tritt meist klinisch erstmals zwischen dem 16. und
35. Lebensjahr auf, ähnlich wie die Multiple Sklerose. Bei
vielen dieser Fälle kam es während der Geburt zu
Komplikationen, als Kinder und Jugendliche sind diese Menschen
meist auffallend schüchtern und verschlossen [81].
|
|
|
|
|
|
-
Bei Schizophrenie ist in erster Linie das Denken und die
Wahrnehmung gestört. Die Betroffenen machen häufige
Wechsel zwischen Euphorie und Beklemmung durch, ihnen fällt
es häufig schwer, klar zu formulieren oder andere zu
verstehen. Ihre Sätze wirken häufig sinnlos, weil sie
schnell von einem Gedanken zum nächsten wechseln, sie sind
weniger gewaltbereit als der Durchschnitt der Bevölkerung,
obwohl die häüfig agressiven verbalen Attacken der
Erkrankten etwas anders vermuten lassen [81].
|
|
|
|
|
|
-
Bei Schizophrenen kommt es nicht zu einer gespaltenen
Persönlichkeit [81]!
|
|
|
|
|
|
-
Schizophrene fühlen sich selbst meist nicht krank, obwohl sie
merken, dass sich die Welt um sie herum auf rätselhafte Weise
verändert [81]. Häufig sind
sie sich selber fremd, können Sinneseindrücke nicht mehr
filtern und fühlen sich manchmal verfolgt, viele haben Angst,
vergiftet zu werden, hören Stimmen und sehen Menschen wo
keine sind. Viele empfinden Scham für die verlorene Kontrolle
über sich selbst, kapseln sich ab und 10 bis 15 % begehen
sogar Selbstmord.
|
|
|
|
|
|
-
Als organische Veränderung kommt zunächst zum Schwund an
der grauen Hirnsubstanz im Scheitellappen, welcher sich in der
Folge bis zu den Schläfen- und Stirnlappen des Großhirns
ausbreitet. Die Dopaminausschüttung ist bei den Schizophrenen
übermäßig hochreguliert.
|
|
|
|
|
|
|
|
|
|
|
|
[T]
- zur Definition was ist ein Unfall (Zitat aus [86]):
“Unfall: ein plötzl., vom Betroffenen
unbeabsichtigtes, von außen auf den menschl. Organismus
einwirkendes Ereignis, das zu einer unfreiwilligen Schädigung
des Organismus führt.“. Ein weiteres Zitat aus [87]:
“Unfall: unbeabsichtigtes, zufälliges, kurzfristig
von außen einwirkendes Ereignis, durch das Menschen oder
Sachgüter zu Schaden kommen u. dessen zeitlicher Eintritt
nicht vorhersehbar ist; als Wegeunfall, Arbeitsunfall dem D-Arzt
zuzuleiten; s.a. Trauma.“ Þ
“Trauma: (griech. = Wunde, Verletzung) den Organismus
schädigende (>>traumatisierende<<) Einwirkung,
i.e.S. der so entstandene Schaden. 1) körperl. Trauma.: jede
Läsion durch von außen einwirkende physikal. oder chem.
Faktoren, i.e.S. die durch mechan. Kräfte (s.a. Verletzung,
Wunde, Mehrfachverletzung), unterschieden nach Art u. Mechanismus
der Verletzung(en) (offenes, geschlossenes, einfaches,
kompliziertes, penetrierendes Trauma, Poly-Trauma, 2) psychisches
Trauma ...usw.“.
|
|
|
|
|
|
Anmerkung
vom Autor (A. Hartwig): nach den vorab aufgeführten
medizinischen Unfall-Definitionen muss man den Zeckenstich
sicherlich als penetrierendes (eindringen des
Zecken-Stechapperates), kompliziertes (Schaden nicht eindeutig
sichtbar) Trauma einstufen. Da beim Zeckenstich nur in wenigen
Fällen der Unfall-Schaden bzw. die Wanderröte (EM) als
Zeichen einer Bb-Infektion zu sehen ist, muss wohl im allgemeinen
bei den Verunfallten die keine Wanderöte zeigen, von einen
komplizierten Trauma gesprochen werden. Deswegen bedarf es einer
Abklärung, ob sich das komplizierte Trauma zu ernsthaften
Gesundheitsgefährdung für den Verunfallten entwickeln
kann. Diese Abklärung kann nach heutiger Kenntnis nur mittels
Bb-Zeckenuntersuchung geschehen, da serologische Bb-Tests im
frühen behandelbaren Stadium bisher zweifelhafte unsichere
Ergebnisse liefern. Auch spätere Tests, sind häufig noch
unsicher und können in der Regel nicht zwischen einer akuten
oder einer vorangegangenen Infektion unterschieden.
|
|
|
|
|
|
|
|
|
|
|
|
[U]
- Zitate aus [89]:
>>Zunehmend werden wissenschaftlich nicht ausreichend
evaluierte Verfahren zur Diagnosestellung der Lyme-Borreliose
herangezogen:
|
|
|
|
|
|
·
Der Lymphozyten-Tranformationstest (LTT) misst die
Stimulierbarkeit von Lymphozyten durch Borrelienantigene.
usw.<< - an dieser Stelle nicht weiter ausgeführt,
siehe Meinung des Autors (A. Hartwig) zum LTT-Borrelien auf der
Seite “LTT-Borreliose-Labortest kritisch hinterfragt“.
|
|
|
|
|
|
weiter
im Zitat: >> ·
Im „Visual Contrast Sensitivity Test“
(VCS-Test oder „Graustufentest“) soll durch Messung des
Erkennens von Grautönen indirekt ein Lipophiles Neurotoxin
von Borrelien nachgewiesen werden. Weder eine Rationale noch ein
Nutzen dieses Tests sind belegt. Die Anwendung des VCS-Tests wird
nicht empfohlen.
|
|
|
|
|
|
·Die
Borrelienserologie wurde durch die Verwendung neuer rekombinanter
Antigene deutlich verbessert .<< Zitat Ende.
|
|
|
|
|
|
Anmerkung
vom Autor (A. Hartwig): die Aussage von Seiten der DGfN das die
Borrelienserologie deutlich verbessert wurde, besagt aber längst
noch nicht das sie ausreichend gut ist, bzw. falsch negativ
Befunde ausschließt! Weiter besagt diese Aussage indirekt,
dass die serologischen Testverfahren in der Vergangenheit nicht so
gut waren und auch heute noch nicht 100 Prozent sicher sind. So
hat man mir (A. Hartwig als Patient) z.B. schon im Jahr 1991
versucht von Seiten der klassischen Schulmedizin einzureden, dass
die serologischen Borrelien-Tests gut und sicher seien, obwohl man
zu der Zeit noch längst nicht die heutigen rekombinierten
neuen “in-vivo Marker Tests“ verwendet hat, da sie noch
gar nicht verfügbar waren. Meiner Meinung nach werden in der
klassischen Schulmedizin viele Patienten als Borrelien-negativ und
Hypochonder abgestempelt, nur weil die ach so guten und sicheren
serologischen Tests ihre (bekannten) Schwächen aufweisen und
man lieber ein falsch negatives Ergebnis in kauf nimmt, als ein
falsch positives Ergebnis. Auf diese Weise irren viele Patienten
von (“Fach“)-Arzt zu (“Fach“)-Arzt und liegen
dem Gesundheitssystem auf der Tasche, weil sie ja trotz negativem
Testbefund ihre Gesundheitsprobleme haben. Da die
naturheilkundlichen Ärzte keineswegs ihre Diagnose allein auf
einen VCS-Test stützen, sondern auf umfangreiche klinische
Diagnostik und auch nicht die serologischen Testverfahren
ablehnen, erscheinen mir ihre Diagnoseverfahren sicherer und
menschenwürdiger da man nicht so schnell einen Patienten als
Hypochonder abtut. Ich (A. Hartwig) für mein Teil musste
jedenfalls bei meinem langjährigen Studium der
Borrelien-Literatur lernen, dass was in der klassischen
Schulmedizin und Forschung vor Jahren noch als klar, eindeutig und
100 Prozent sicher dargestellt wurde, dass dies heute teilweise in
ihren eigenen Reihen keine Gültigkeit mehr hat.
|
|
|
|
|
|
|
|
|
|
|
|
[V]
- In der Borrelien-Interaktion mit den Fibroblasten,
Fibrozyten und dem Fibronektin (Fibronectin) kann eventuell auch
die Verbindung zum
Weichteilrheumatismus (= Fibromyalgie-Syndrom o.
Fibrozyten-Syndrom) bestehen. Hiebei handelt es sich um eine
schmerzhafte Erkrankung des Muskelgewebes, der Sehnen und
Schleimbeutel sowie des Unterhautfett- u. Bindegewebes
(Pannikulitis) - siehe auch Seite Symptome. Auch zu einigen
Krebsformen könnte hier ein Zusammenhang bestehen, da z.B.
das Fibronektin (Fibronectin) ein Glycoprotein der Zellmembranen
ist, welches besondere Bedeutung für die Zelladhäsion
(Halt untereinander) inne hat aber auch unter bestimmten
Umgebungsbedingungen mitverantwortlich ist für die maligne
Transformation (bösartigen Veränderung).
|
|
|
|
|
|
Decorin
= ein in den Zellzwischenräumen vorkommende Substanz
(extrazelluläres Matrix-Proeoglycan)
|
|
|
|
|
|
Matrix
= Bindegewebe in den Zellzwischenräumen
|
|
|
|
|
|
DbpA
u. DbpB = temperaturabhängige Borrelien-Adhäsine, Dbp:
Decorin-Binding Protein/e
|
|
|
|
|
|
Fibroblasten
= Stammzellen des Bindegewebes, Vorstufe der Fibrozyten
|
|
|
|
|
|
Fibrozyten
= langfaserige Grundzellen des Bindegewebes, meist spindelförmig
mit vielen Fortsätzen
|
|
|
|
|
|
Fibronektin
/ Fibronectin = Glycoproteine der Zellmembranen, ein wichtiges
Plasmaprotein mit Bindungsneigung zu verschiedenen Substraten. Es
kommt an der Oberfläche von Makrophagen, Leberzellen,
Epithel- und Endothelzellen vor, weiter bildet es Kittsubstanz und
Gerüstproteine im Organismus. Der Hauptbildungsort für
Fibronektin sind die Lebrzellen.
|
|
|
|
|
|
Plasminogen
(Profibrinolysin) = noch nicht aktivierte Vorstufe des Plasmin
(früher Fibrinolysin). Plasmin ist z.B. an der Auflösung
von Fibrin-Gerinnseln beteiligt. Ist das Plasminsystem gestört,
kann es zur Gerinnselbildung kommen, denkbare Folge: Schlaganfall.
Plasminogen-Aktivatoren (tissue-type Plasminogen Activator = t-PA)
befinden sich in vielen Geweben, es handelt sich hierbei um ein
Glykoprotein mit einem Molekulargewicht von ca. 68 kD (kDa). 68
kD-Bande (= sogen. Hitze-Schock-Protein) treten auch in der
serologischen Borreliendiagnostik als Marker-Bande auf, sind
deswegen normalerweise als nicht diagnostische Bande eingestuft.
|
|
|
|
|
|
(wörtlich:
Ergänzungssystem): die Komplement-Blutproteine sind ein
wichtiger Faktor, sie ergänzen (komplementieren) z.B. die
Wirkung von Antikörpern. Das wird auch angeborenes
Abwehrsystem genannt, da es Bakterien und andere Zellen unter
bestimmten Bedingungen ohne Hilfe direkt töten kann, indem es
es regelrecht Löcher in sie ätzt. Durch die porenartigen
Löcher in der Zellmembran dringt dann Wasser in die Zellen
ein und bringt sie anschließend zum platzen. Die
körpereigenen Zellen verfügen über Proteine die das
Komplement inaktivieren, auf diese Weise unterscheidet schon die
angeborene Abwehr zwischen “Selbst“ und “Nicht
Selbst“. Aber auch einigen Bakterien gelingt es sich dem
Komplement zu entziehen oder auf dieses Einfluss zu nehmen, so
z.B. Pneumokokken, Streptokokken und Borrelien.
|
|
|
|
|
|
Als
gesichert gilt heute, das dass Komplementen-System Fresszellen
(Phagozyten, Makrophagen) aktiviert, am Immunkomplextransport
beteiligt ist, mitwirkt an der Beseitigung von Bakterien und
Immunkomplexen, an der Beseitigen von Zielzellen (Zytolyse) usw.
|
|
|
|
|
|
|
|
|
|
|
|
[W]
- Vergleichen wir die Epigenetik mit einem
Bahnstreckennetz, dann ist das Streckennetz die gesamte DNA (=
komplettes Erbgut), die einzelnen Schienenstränge die
DNA-Sequenzen (= Erbgutabschnitte) und die Weichen die
epigenetischen Schaltpunkte (= Methylierungs-Stellen auf der DNA).
Ein Zug stellt ein Individium dar, die Bewegung des Zuges den
Lebensverlauf des Individiums und der Stellwerker die Umgebung.
Legt der Stellwerker eine oder einige Weichen um, dann wird der
kommende Zug (= Mutter bzw. Vater) und seine Nachfolger (= Kinder)
diese vorgegebene Strecke fahren. Der vorgegebene Streckenverlauf
steht bei diesem Beispiel für die aktivierten
Erbgutabschnitte, die nicht genutzten Strecken stellen die nicht
aktivierten Erbgutabschnitte dar. Der Zug (= Individium) selber
hat keinen Einfluss auf den Streckenverlauf, wohl aber der
Stellwerker (= Umgebungseinfluss) der die Weichen (=
Methylierungs-Stellen auf der DNA) umlegen kann.
|
|
|
|
|
|
Man
könnte auch einen Spielbaukasten als Vergleich nehmen. Der
Baukasten (Kiste) ist die zusammenhängende Säugetier-DNA
(z.B. v. Mensch). Die Baussteine sind die einzelnen Gene der
Säugetier-DNA. Die Teileaufstellung über die benötigten
Bausteine und die Bauanleitung ist die Epigenetik, die festlegt,
welche Steine zum bauen benutzt werden sollen und welche nicht.
Die Bauanleitung ist die Epi-genetisch festgelegte Reihenfolge der
Arbeitsschritte, nach denen der Erbauer des Endprodukt zusammen
baut. Geht mal ein Bausstein des Baukasten verloren, dann ist dies
nicht weiter schlimm sofern noch Ersatz vorhanden ist. Der
Ersatz-Bausstein ist gleichzusetzen mit den vielen normalerweise
ungenutzten Genen auf der Säugetier-DNA (= abgeschaltet bzw.
stumme Gene / methylierte Gene). Umgekehrt ist es auch nicht
schlimm, wenn ein fremder Bausstein in den Baukasten gelangt (=
Viren o. Bakterien-DNA / Episom), sofern dieser Stein nicht mit in
die Teileaufstellung und Bauanleitung aufgenommen wird (=
epigenetische Information). Die Aufnahme kann “bewusst“
durch Ausprobieren geschehen, da das Endprodukt hierdurch
verbessert wird (= Evolution). Das Hinzufügen kann aber
heimlich durch einen Gegenspieler geschehen (= Bakterien-DNA /
Episom), weil dieser hierdurch z.B in einem Wettbewerb (=
Überlebenskampf der verschiedenen Organismen) Vorteile
erlangt.
|
|
|
|
|
|
|
|
|
|
|
|
[X]
- Es gibt Mediziner (Ärzte, z.B. [136])
die sagen das kein Indiz für eine Zeckenuntersuchung
vorliegt, dies kann ich nach meinem erlangten Wissen über
Borrelieninfektionen nicht ganz nachvollziehen (siehe auch Punkt
[R]). Da 6 Prozent der Zeckenstichen
zu einer allgemein anerkannten Borrelien-spezifischen
serologischen Reaktion führen und ca. 1-2 Prozent in eine
gesicherten Lyme-Erkrankung übergehen - zuzüglich der
Dunkelziffer bei denen kein serologischer Nachweis gelingt.
Demgegenüber steht z.B. das nur 0,05 bis 0,1 Prozent der
Zeckenstiche in den entsprechenden Endemiegebieten zur
FSME-Erkrankung führen, von denen allerdings wiederum nur ein
sehr geringer Prozentsatz eine schwere Hirnhautentzündung
bekommt. Bei der FSME spricht man sich für eine aktive
Immunisierung [a] bei Personen aus
die ein Endemiegebiete aufsuchen, obwohl nach einem erfolgten
Zeckenstich innerhalb von 96 Stunden auch noch passiv Immunisiert
[b] werden kann. Das bedeutet bei der
FSME akzeptiert man ca. 999-1999 “überflüssige“
Impf-Prophylaxen. Geht man nun davon aus das im Schnitt 35 von 100
Zecken mit Borrelien infiziert sind, würde dies bei 100
Zeckenstichen zu 65 Negativbefunden bei den untersuchten Zecken
führen. Die Zeckenuntersuchung führt somit maximal bei
ca. 35 abgezupften angesogenen Zecken zu einem positiven
Borrelienbefund. Das würde wiederum bedeuten, dass faktisch,
setzen wir die oben aufgeführten Daten zu Grunde, maximal 29
Patienten eine eventuell nicht nötige Antibiose bekämen.
Da es aber bei der Lyme-Borreliose nachgewiesener Weise im
behandelbaren Stadium (1. Stadium) zu sehr vielen serologischen
Negativfällen kommt (ca. 60-70 % / im Schnitt ca. 50 %
[137]),
bekommen wahrscheinlich tatsächlich nur sehr wenige Patienten
eine überflüssige Antibiose.
|
|
|
|
|
|
Natürlich
kann man nun sagen, mit jeder überflüssigen Antibiose
fördert man eine Resistenzbildung der Krankheitserreger, z.B.
auch der Borrelien. Dies sehe ich differenzierter. In diesem
frühen Infektionsstadium, nach positiven
Borrelien-Zeckenbefund, wird man mit sehr großer
Wahrscheinlichkeit alle Borrelien, bevor diese ihre Nischen
erreichen, mit der Antibiose eliminieren und so sicher eine
Borrelienerkrankung vermeiden. Da man sehr früh - präventiv
- ins Infektionsgeschehen eingreift, in der Phase wo sich die
Borrelien erst ihrem neuen Wirt anpassen müssen. Ich sehe die
Gefahr einer Resistenzförderung eher bei den teilweise recht
“lieblos“, nur für 10 Tage, verabreichten Antibiose
zu Beginn einer serologisch gesicherten Borrelieninfektion (siehe
Blatt: Antibiotikumtherapie, Stadium 1). Auch bei den recht
zahlreichen Patienten (ca. 60-70 %), bei denen erst in einem
späteren Stadium der Borreliose ( Stadium 2 ) die
serologische Sicherung der Infektion gelingt, wird von vielen
Fachleuten die antibiotische-Erreichbarkeit der Borrelien in ihren
Nischen (z.B. Epithelzellen u. Makrophagen) angezweifelt. Auch
diesen Patienten verabreicht man auch heute noch i.d.R. eher zu
kurz das entsprechende Antibiotikum (siehe Seite:
Antibiotikumtherapie, finnische Studie), was mit ziemlicher
Sicherheit nicht unbedingt Resistenzbildung vermeidet. So darf
sicherlich die Frage gestellt werden, welche Art der Behandlung
eine Resistenzbildung mehr fördert: die präventive kurze
Antibiose nach positiven Borrelien-Zeckenbefund oder ein späterer
Versuch die Borrelien mit dem Antibiotikum in ihren Nischen zu
erreichen.
|
|
|
|
|
|
Auch
das Leid der Patienten, die von Facharzt zu Facharzt geschickt
werden, bei denen nicht zu 100 Prozent die diagnostische Sicherung
einer Borreliose gelingt, denen man eine Antibiose verweigert,
darf man bei der Diskussion nicht vergessen. Ihnen fügt man
teilweise in Rahmen der Diagnosefindung sicherlich wesentlich
größere Gesundheitsrisiken zu, als z.B. eine eventuelle
kurze präventive “überflüssige“ Antibiose
dies darstellt. Ich möchte dies mal am Beispiel der
Röntgenstrahlen, die in Sivert (Sv) bzw. Millisievert (mSv)
gemessen werden, verdeutlichen. Bei Untersuchungen mit dem
Computer-Tomographen (CT) fallen z.B. folgende Strahlendosen an:
CT Kopf 2-4 mSv, CT Brustkorbes 6-10 mSv und CT Wirbelsäule
2-11 mSv. Die natürliche Strahlenbelastung beträgt bei
uns im Schnitt 2.1 mSv - so bekommt man z.B. beim Kopf-CT die
1-2fache und bei einer Wirbelsäulen-CT die 1-5fache
Strahlendosis ab. Eine grobe Kalkulation des Bundesamt für
Strahlenschutz geht davon aus, dass von 1000 Menschen, die einer
Strahlendosis von 10 mSv ausgesetzt sind, ein bis zwei zusätzlich
im Lauf ihres Lebens an Krabs erkranken [135].
|
|
|
|
|
|
So
vermeidet man bei der FSME durch Impfprophylaxe schwere
Einzelschicksale, was meiner Meinung nach durchaus die
FSME-Impfung rechtfertigt - eine ähnliche Rechtfertigung sehe
ich aber auch bei der Zeckenuntersuchung auf Borrelien
(Zecken-Bb.sl.-PCR) mit anschließender Antibiose-Prophylaxe,
bei positiven Borrelien-Zecken-Befund (positive
Zecken-Bb.sl.-PCR), gegeben. Auch hiermit vermeidet man mit großer
Sicherheit schwere Einzelschicksale. Ich möchte an dieser
Stelle eine E-Mail auszugsweise zitieren, die ich als Reaktion auf
meine Homepage am 28.08.2007 erhalten habe, dort schreibt der
Absender wie folgt: .....ist vor einigen Jahren zwangsweise
Rentner geworden, als er nach einer zu spät erkannten
Borreliose zuerst ein unverträgliches Medikament erhielt (die
Haut begann sich großflächig abzulösen), später
dann schwer am Herzen erkrankte, wo sich die Borrelien eingenistet
haben und er sie wohl auch nie mehr los wird. Er darf seine
Herz-Ruheleistung nur wenig überschreiten, sonst führt
das zu irreversiblen Schäden. ...
|
|
|
|
|
|
Der
Borrelienserologie kämme aber nach wie vor einen hoher
Stellenwert zu, da viele Betroffenen gar keinen Zeckenstich
bemerken und auch eine Zecken-Bb.sl.-PCR nicht die absolute
Sicherheit bietet.
|
|
|
|
|
|
[a]
- Im Volksmund auch >> Schutzimpfung << genannt =
Hierbei wird dem Mensch (o. Tier) meist durch Injektion ein
Impfstoff verabreicht, der aus abgeschwächten oder
abgetöteten Krankheitserregern besteht - heute teilweise auch
synthetisch hergestellte Antigenstrukturen. Die auf diese Weise
verabreichten Impf-Erreger stimulieren das Immunsystem ähnlich
wie eine echte Infektion und führen so zur Bildung von
Antikörpern (AK), B-Zellen u. T-Gedächtnis-Zellen.
Dadurch kommt es im Falle einer Infektion mit dem entsprechenden
Erreger, zur schnellen Immunantwort weil die Abwehr schon
entsprechend sensibilisiert ist.
|
|
|
|
|
|
[b]
- Die passive Immunisierung erzeugt einen künstlich
erworbenen Schutz gegen den entsprechenden Erreger. Bei dieser
Form der Immunisierung verabreicht man den Körper
entsprechende fertige Antikörper (AK), die eine Bindung mit
dem Erreger eingehen und somit eliminieren oder bewegungsunfähig
machen. Durch die Markierung der Erreger mit dem künstlich
zugeführten AK erkennen infolge die Immunzellen den
Eindringling und beseitigt diesen auf den normalen immunologischen
Weg, als wenn der Körper die AK selbst gebildet hätte.
Die AK, auch Immunglobulin genannt, für die passive
Immunisierung stammen meist aus dem Blut von Tieren. Nachteil der
passiven Immunisierung, sie stimuliert nicht die Bildung von
Gedächtniszellen wie dies bei der aktiven Immunisierung
geschieht.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|